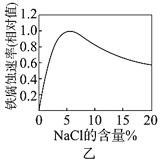
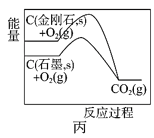
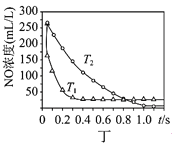
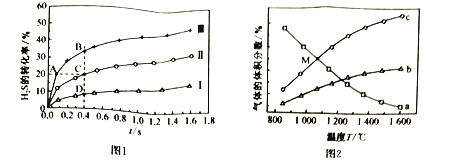
题目内容
【题目】下列实验设计及其对应的离子方程式均正确的是
A.氯气溶于水制备次氯酸:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
B.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:5 H2O2+2MnO4-+6H+ === 5O2↑+2Mn2++8H2O
C.向澄清石灰水中加入少量的NaHCO3溶液产生沉淀:Ca2++OH-+HCO3-=== CaCO3↓+H2O
D.用铜做电极电解NaCl溶液制备氯气:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
【答案】C
【解析】
A.氯气与水反应生成盐酸和次氯酸,次氯酸为弱酸不能拆开,反应的离子方程式为:Cl2+H2OH++Cl-+HClO,A错误;
B.高锰酸钾能够氧化浓盐酸中的氯离子,对过氧化氢还原性检验造成干扰,实验设计不合理,B错误;
C.澄清石灰水与少量的NaHCO3溶液反应生成碳酸钙、氢氧化钠和水,反应的离子方程式为:Ca2++OH-+HCO3-=CaCO3↓+H2O,C正确;
D.铜为活性电极,会参与反应,用铜做电极电解NaCl溶液的离子方程式为:Cu+2H2O![]() H2↑+Cu(OH)2↓,D错误。
H2↑+Cu(OH)2↓,D错误。
答案选C。

练习册系列答案
相关题目