题目内容
7.熔融碳酸盐燃料电池(MCFC)是使用熔融碳酸锂、碳酸钾作电解质的一种新型电池,该电池的工作温度为650℃.负极由镍铬铝合金烧结而成,正极材料为多孔镍,电池反应为:H2+CO+O2=CO2+H2O.下列说法正确的是( )| A. | 负极反应Al-3e-Al3+ | B. | 燃料气体是氧气 | ||
| C. | 正极反应为2CO2+O2+4e-2CO32- | D. | 该电池不能用烃类物质作燃料 |
分析 该燃料电池中,由电池反应为:H2+CO+O2=CO2+H2O,则负极上燃料失电子发生氧化反应,电极反应式为CO-2e-+CO32-═2CO2、H2-2e-+CO32-═CO2+H2O,正极上氧气得电子发生还原反应,电极反应式为2CO2+O2+4e-═2CO32-,据此分析解答.
解答 解:A.该电池中,负极上燃料失电子发生氧化反应,电极反应式为CO-2e-+CO32-═2CO2、H2-2e-+CO32-═CO2+H2O,故A错误;
B.根据电池反应式知,该电池燃料是一氧化碳和氢气,故B错误;
C.正极上氧气得电子发生还原反应,电极反应式为2CO2+O2+4e-═2CO32-,故C正确;
D.烃中含有碳、氢元素,也可以作燃料,所以该电池也可用烃类作燃料,故D错误;
故选:C.
点评 本题考查了化学电源新型电池,根据电池反应式确定正负极上得失电子的物质及反应类型,难点是电极反应式的书写,要注意结合电解质书写,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且有些可以再生.下列属于最有希望的新能源的是( )
①天然气 ②煤 ③核能 ④太阳能 ⑤生物质能 ⑥风能 ⑦氢能.
①天然气 ②煤 ③核能 ④太阳能 ⑤生物质能 ⑥风能 ⑦氢能.
| A. | ①②③④ | B. | ②⑤⑥⑦ | C. | ①③④⑤⑥ | D. | 除①②外 |
18.下列的实验事实和解释或结论都正确的是( )
| 选项 | 实验事实 | 解释或结论 |
| A | 2N2O5(g)?4NO2(g)+O2(g)△H>0 在室温下能自发进行 | 这是一个熵增的反应 |
| B | 向0.1mol•L-1的氨水中通入少量氨气,溶液的pH减小 | 电离平衡向逆方向移动,溶液中的c(OH-) 减小 |
| C | 锌与稀硫酸反应过程中,开始反应后速率逐渐增大 | 该反应是放热反应 |
| D | 已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动 | 反应物的浓度一定降低 |
| A. | A | B. | B | C. | C | D. | D |
2.下列离子方程式中正确的是( )
| A. | Cu(OH)2与盐酸反应:H++OH-=H2O | |
| B. | 氨气通入醋酸溶液中:NH3+CH3COOH=CH3COO-+NH4+ | |
| C. | MgSO4溶液与Ba(OH)2溶液反应:SO42-+Ba2+=BaSO4↓ | |
| D. | CaCO3与稀盐酸反应:CO32-+2H+=H2CO3 |
12.反应3NO2+H2O=2HNO3+NO中,当有4mol电子发生转移时,被氧化的物质与被还原的物质的物质的量之比是( )
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 3:1 |
3.工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
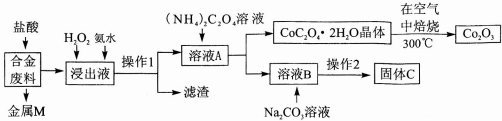
(1)金属M为Cu,操作1为过滤.
(2)加入H2O2的作用是(用离子方程式表示)2Fe2++H2O2+2H+=2Fe3++2H2O,加入氨水的作用是调节溶液的pH使Fe3+转化为Fe(OH)3沉淀.
(3)充分焙烧的化学方程式为4CoC2O4?2H2O+3O2$\frac{\underline{\;焙烧\;}}{\;}$2Co2O3+8 H2O+8CO2.
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表.操作2中,蒸发浓缩后必须趁热过滤,其原因是减少Li2CO3的溶解损失,90℃时Ksp(Li2CO3)的值为4.0×10-3.
(5)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,则阳极的电极反应式为2CO32--4e-=O2↑+2CO2↑.

(1)金属M为Cu,操作1为过滤.
(2)加入H2O2的作用是(用离子方程式表示)2Fe2++H2O2+2H+=2Fe3++2H2O,加入氨水的作用是调节溶液的pH使Fe3+转化为Fe(OH)3沉淀.
(3)充分焙烧的化学方程式为4CoC2O4?2H2O+3O2$\frac{\underline{\;焙烧\;}}{\;}$2Co2O3+8 H2O+8CO2.
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表.操作2中,蒸发浓缩后必须趁热过滤,其原因是减少Li2CO3的溶解损失,90℃时Ksp(Li2CO3)的值为4.0×10-3.
| 温度/℃ | 10 | 30 | 60 | 90 |
| 浓度/mol•L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
1.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 71g氯气与过量的FeCl2溶液完全反应转移的电子数为2NA | |
| B. | 1 mol甲基(-14CH3)所含中子数为9NA | |
| C. | 在标准状况下,2.24L四氯甲烷所含的分子数为0.1NA | |
| D. | 2L 0.1mol/L 的醋酸钠溶液中,所含离子总数是0.2NA |