题目内容
【题目】高铁酸钾 (K2FeO4)是一种新型,高效的绿色水处理剂。工业上利用硫酸亚铁为原料,通过铁黄 (FeOOH)制备高铁酸钾,可降低生产成本产品质量优工艺流程如下:

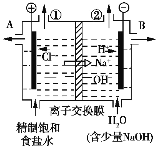
化学兴趣小组的同学们在实验室中,通过KClO溶液与Fe(NO3)3溶液的反应模拟工业生产制备高铁酸钾,下图所示是模拟工业制备KClO溶液装置。

已知:K2FeO4可溶于水、微溶于浓KOH溶液;在强碱性溶液中比较稳定;在Fe3+催化作用下发生分解。
(1)工业流程中,需要加入试剂A制备铁黄(FeOOH),最合适的试剂A是:________。
A.Cl2 B.O2 C.KMnO4 D.HNO3
流程中制备铁黄涉及到的离子反应方程式:_______。
实验测得反应溶液的pH对铁黄产率的影响如下图所示,pH大于4.5时铁黄产率逐降低的主要原因可能是:______。

(2)根据工业流程推断,溶解度K2FeO4________ Na2FeO4 (填“>”或“<”)
(3)实验室使用KClO溶液和饱和Fe(NO3)3液制备高铁酸钾时,两种试剂的滴加顺序为________。
(4) K2FeO4在水溶液中易水解,在“提纯”K2FeO4中采用重结晶洗涤、低温烘干的方法,则洗涤剂最好选用____溶液(填序号)
a.水 b.NH4Cl、异丙醇 c. Fe(NO3)3、异丙醇 d.异丙醇
(5)工业上用“间接碘量法”测定高铁酸钾的纯度:用碱性KI溶液溶解1.00g K2FeO4样品,调节pH使高铁酸根全部被还原成亚铁离子,再调节pH为3~4,用1.00mol/l的Na2S2O3标准溶液作为滴定剂进行滴定(2Na2S2O3+I2= Na2S4O6+2NaI),淀粉作指示剂,三次滴定,消耗Na2S2O3标准溶液分别17.98、18.02、18.95mL。原样品中高铁酸钾的质量分数为________。[M(K2FeO4)=198g/mol]
【答案】B ![]() 酸性减弱,生成的
酸性减弱,生成的![]() 增多 < 将
增多 < 将![]() 缓慢滴入
缓慢滴入![]() 溶液中,保持
溶液中,保持![]() 溶液过量 d 89.1%
溶液过量 d 89.1%
【解析】
制备高铁酸钾:硫酸亚铁中+2价的铁具有还原性,氧气具有氧化性,两者反应生成铁黄,反应为:![]() ,氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,反应的化学方程式为:Cl2+2NaOH═NaCl+NaClO+H2O,铁黄和次氯酸钠反应生成高铁酸钠,2FeOOH+3NaClO+4NaOH=2Na2FeO4+3NaCl+3H2O,高铁酸钠在溶液中溶解度大于高铁酸钾,加入氯化钾,2KOH+Na2FeO4=K2FeO4+2NaOH,高铁酸钠在溶液中转化成高铁酸钾,静置,抽滤获得粗产品,据此分析解答。
,氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,反应的化学方程式为:Cl2+2NaOH═NaCl+NaClO+H2O,铁黄和次氯酸钠反应生成高铁酸钠,2FeOOH+3NaClO+4NaOH=2Na2FeO4+3NaCl+3H2O,高铁酸钠在溶液中溶解度大于高铁酸钾,加入氯化钾,2KOH+Na2FeO4=K2FeO4+2NaOH,高铁酸钠在溶液中转化成高铁酸钾,静置,抽滤获得粗产品,据此分析解答。
(1)制备铁黄(FeOOH),选择的氧化剂反应后不能引入新的杂质离子,最合适的试剂A是氧气,硫酸亚铁在催化剂作用下,被氧气氧化生成铁黄(FeOOH),结合电子守恒、电荷守恒及原子守恒写出发生反应的离子方程式;根据图示的实验测得反应溶液的pH对铁黄产率的影响分析;
(2)根据工业流程向Na2FeO4溶液中加入KCl固体后得到K2FeO4,溶解度小的析出,以此来解答;
(3)由信息可知K2FeO4在Fe3+催化作用下发生分解,在KOH溶液中,Fe(NO3)3与KClO应生成K2FeO4、KCl和KNO3;
(4)选择的洗涤剂应能抑制K2FeO4的水解,并注意减少K2FeO4的溶解;
(5)三次滴定,消耗Na2S2O3标准溶液分别17.98、18.02、18.95mL.第三组数据偏差大,需舍去,由电子得失守恒可知![]() ~2I2,结合2Na2S2O3+I2═Na2S4O6+2NaI,得关系式
~2I2,结合2Na2S2O3+I2═Na2S4O6+2NaI,得关系式![]() ~2I2~4Na2S2O3,以此计算。
~2I2~4Na2S2O3,以此计算。
(1)硫酸亚铁中+2价的铁具有还原性,
A.Cl2引入氯离子,故A不选;
B.O2不引入新的杂质离子,故B选;
C.KMnO4引入新的杂质离子锰离子,故C不选;
D.HNO3引入新的杂质离子硝酸根离子,故D不选;
氧气具有氧化性,两者发生氧化还原反应生成铁黄,反应为:![]() ,根据图象,pH大于4.5时,酸性减弱生成了氢氧化铁,使得铁黄产率降低;
,根据图象,pH大于4.5时,酸性减弱生成了氢氧化铁,使得铁黄产率降低;
故答案为:B;![]() ;酸性减弱,生成的
;酸性减弱,生成的![]() 增多;
增多;
(2)根据工业流程向Na2FeO4溶液中加入KCl固体后得到K2FeO4,反应为:Na2FeO4+2KCl=K2FeO4↓+2NaCl,生成K2FeO4晶体,说明该温度下K2FeO4溶解度小于Na2FeO4,
故答案为:<;
(3)制备K2FeO4时,不能将碱性的KClO溶液滴加到Fe(NO3)3饱和溶液中,其原因是将KClO浓溶液滴加到Fe(NO3)3饱和溶液中,Fe3+过量,K2FeO4在![]() +3Cl+5H2O,所以使用KClO溶液和饱和Fe(NO3)3溶液制备高铁酸钾时,两种试剂的滴加顺序为:将Fe(NO3)3缓慢滴入KClO溶液中,保持KClO溶液过量,
+3Cl+5H2O,所以使用KClO溶液和饱和Fe(NO3)3溶液制备高铁酸钾时,两种试剂的滴加顺序为:将Fe(NO3)3缓慢滴入KClO溶液中,保持KClO溶液过量,
故答案为:将Fe(NO3)3缓慢滴入KClO溶液中,保持KClO溶液过量;
(4) K2FeO4在水溶液中易水解呈碱性,应选择碱性非水溶液抑制K2FeO4水解,进行洗涤。
a.K2FeO4在水溶液中易“水解”:4![]() +10H2O4Fe(OH)3+8OH+3O2,且容易损失,不能用水洗,故a错误;
+10H2O4Fe(OH)3+8OH+3O2,且容易损失,不能用水洗,故a错误;
b.NH4Cl不能抑制水解,促进水解,故b错误;
c.Fe(NO3)3不能抑制水解,促进水解,故c错误;
d.异丙醇,能抑制水解,减少洗涤损失,故d正确,
故答案为:d;
(5)三次滴定,消耗Na2S2O3标准溶液分别17.98、18.02、18.95mL.第三组数据偏差大,需舍去,用去硫代硫酸钠标准溶液![]() =18.00mL.,由
=18.00mL.,由![]() ~2I2~4 Na2S2O3,可知原样品中高铁酸钾的质量分数为
~2I2~4 Na2S2O3,可知原样品中高铁酸钾的质量分数为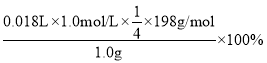 =89.1%,
=89.1%,
故答案为:89.1%。