题目内容
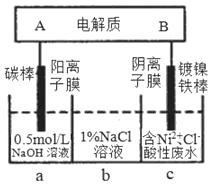
【题目】该装置为锂钒氧化物二次电池,其成本较低,对环境无污染:![]() 在下图中用该电池电解含镍酸性废水可得到单质镍(已知:
在下图中用该电池电解含镍酸性废水可得到单质镍(已知:![]() )。下列说法不正确的是( )
)。下列说法不正确的是( )
A.该电池充电时,A电极的电极反应式为![]()
B.电解过程中,b中NaCl溶液的物质的浓度会增大
C.当锂钒氧化物二次电池中有7gLi参与放电时,一定能得到29.35g镍
D.锂钒氧化物二次电池一般用非水溶液作为电解液
【答案】C
【解析】
用该电池电解含镍酸性废水可得到单质镍,则镀镍铁棒作阴极,铁棒作阳极,则A为正极、B为负极。电解过程中,碳棒上氯离子放电生成氯气,则a中钠离子进入b区,镀镍铁棒上氢离子放电生成氢气,则氯离子进入b区。
A.该电池充电时,A电极失电子发生氧化反应,电解反应式为LixV2O5-xe-═V2O5+xLi+,故A正确;
B.电解过程中,碳棒上氯离子放电生成氯气,则a中钠离子进入b区,镀镍铁棒上氢离子放电生成氢气,则氯离子进入b区,所以导致b区域NaCl浓度增大,故B正确;
C.串联电路中转移电子相等,如果锂钒氧化物二次电池中有7gLi参与放电时,转移电子物质的量=![]() ×1=1mol,当随着电解的进行,c(Ni2+)减小,H+的放电大于Ni2+,则得到Ni的物质的量小于
×1=1mol,当随着电解的进行,c(Ni2+)减小,H+的放电大于Ni2+,则得到Ni的物质的量小于![]() ×1mol=0.5mol,m(Ni)小于0.5mol×58.7g·mol-1=29.35g,故C错误;
×1mol=0.5mol,m(Ni)小于0.5mol×58.7g·mol-1=29.35g,故C错误;
D.Li能和水反应生成LiOH,所以锂钒氧化物二次电池不能用LiCl水溶液作为电解液,故D正确;
故选C。

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目