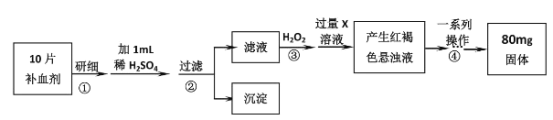
题目内容
【题目】下图是工业电解饱和食盐水的装置示意图,下列有关说法不正确的是
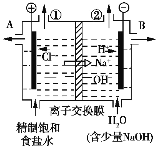
A. 装置中的离子交换膜只能让阳离子通过,不能让阴离子通过
B. 装置中出口①处的物质是氢气,出口②处的物质是氯气
C. 除去杂质后的氢氧化钠溶液从出口B处导出
D. 转移0.8 mol电子时产生氢气8.96 L(标准状况)
【答案】B
【解析】
A.离子交换膜有选择性,根据图象可知,该离子交换膜只能让阳离子通过,不能让阴离子通过,故A正确;
B.根据图知,左边装置氯离子放电生成氯气、右边装置氢离子放电生成氢气,所以装置中出口①处的物质是氯气,出口②处的物质是氢气,故B错误;
C.根据图知,左边装置氯离子放电生成氯气、右边装置氢离子放电生成氢气,右边氢氧根离子浓度增加,碱性增强,所以除去杂质后的氢氧化钠溶液从出口B处导出,故C正确;
D.电解反应式为2Cl-+2H2O↑![]() Cl2↑+H2↑+2OH-,转移电子2mol时产生氢气1mol,转移电子0.8mol时产生氢气0.4mol,标况下的体积是8.96L,故D正确;
Cl2↑+H2↑+2OH-,转移电子2mol时产生氢气1mol,转移电子0.8mol时产生氢气0.4mol,标况下的体积是8.96L,故D正确;
答案选B。

练习册系列答案
相关题目