题目内容
【题目】研究氢的获得和应用具有重要意义。
(1)已知:![]() 将0.20molH2S气体充入密闭容器中,保持恒压(p=a)、温度T1条件下进行上述反应。
将0.20molH2S气体充入密闭容器中,保持恒压(p=a)、温度T1条件下进行上述反应。
①下列可以作为反应达到平衡状态的判据是________。
A.气体的平均相对分子质量不变
B.![]()
C.K不变
D.容器体积不变
②![]() 时刻反应达到平衡,H2S的平衡转化率为40%。该反应的平衡常数Kp=________(用a的代数式表示。对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=p·x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数)。
时刻反应达到平衡,H2S的平衡转化率为40%。该反应的平衡常数Kp=________(用a的代数式表示。对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=p·x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数)。
③反应温度T1时,画出0~t2时段,n(S2)随时间变化曲线[n(S2)—t]。保持其它条件不变,改变反应温度为T2(T2>T1),画出0~t2时段,n(S2)随时间变化趋势的曲线[n(S2)—t]________

(2)已知:某催化剂作用下,H2还原NO的反应有两种可能:
Ⅰ.![]()
Ⅱ.![]()
反应历程可以表示为(![]() 表示吸附态)
表示吸附态)
吸附分解:![]() ①
①
![]() ②
②
反应脱附:![]() ③
③
![]() ④
④
![]() ⑤
⑤
其中,反应脱附过程中④与⑤是一组竞争关系,决定了H2还原NO的最终产物。
①如图显示不同温度条件下,原料气![]() ,达到平衡时体系中N2和N2O的含量,由此判断
,达到平衡时体系中N2和N2O的含量,由此判断![]() ________0(填“>”或“<”);判断反应脱附过程中④与⑤两步反应的活化能高低并说明理由________。
________0(填“>”或“<”);判断反应脱附过程中④与⑤两步反应的活化能高低并说明理由________。

②如图显示不同温度条件下,原料气![]() 分别为1、2、3(对应图中标注“1”、“2”、“3”),达到平衡时,体系中N2和N2O的含量,由此可知,增加H2的量,可以增加________的选择性(填“N2”或“N2O”)
分别为1、2、3(对应图中标注“1”、“2”、“3”),达到平衡时,体系中N2和N2O的含量,由此可知,增加H2的量,可以增加________的选择性(填“N2”或“N2O”)

【答案】ABD ![]() (0.074a)
(0.074a)  > 由图可知温度低时以反应④为主,温度高时以反应⑤为主,说明反应⑤具有较高的反应活化能 N2
> 由图可知温度低时以反应④为主,温度高时以反应⑤为主,说明反应⑤具有较高的反应活化能 N2
【解析】
(1)①根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化;
②初始投料为0.20molH2S,转化率为40%,列三段式有:
 ,据此分析作答;
,据此分析作答;
③根据温度对平衡的影响结合三段式分析;
(2)①吸热反应焓变大于0,放热反应焓变小于0;活化能越高反应越不容易进行;
②分析投料比对选择性的影响,则需要在相同温度条件下比较改变投料比产物中各物质含量的变化。
(1)①A.该反应反应物和生成物均为气体,且前后气体系数之和不相等,所以气体总物质的量会变,而总质量不变,所以未平衡时气体的平均相对分子质量会变,当其不变时,说明反应达到平衡,故A符合题意;
B.同一反应同一时段反应速率之比等于计量数之比,所以v正(H2S)=2v正(S2),所以当v正(H2S)=2v逆(S2)时,也即v正(S2)= v逆(S2),说明反应平衡,故B符合题意;
C.平衡常数只与温度有关,无论反应是否平衡,只要温度不变K就不变,所以K不变不能说明反应平衡,故C不符合题意;
D.反应过程中恒压,而前后气体系数之和不相等,所以未平衡时容器体积会变,当体积不变时说明反应平衡,故D符合题意;
综上所述选ABD;
②根据分析可知平衡时n(H2S)=0.12mol,n(H2)=0.08mol,n(S2)=0.04mol,气体总物质的量为0.12mol+0.08mol+0.04mol=0.24mol,总压强为a,所以p(H2S)=![]() ,同理可知p(H2)=
,同理可知p(H2)=![]() a,p(S2)=
a,p(S2)=![]() a,所以Kp=
a,所以Kp= =
=![]() ;
;
③反应温度T1时,初始投料为0.20molH2S,所以反应过程中S2的物质的量增大,t1时反应达到平衡,S2的物质的量不再改变,根据三段式可知平衡时n(S2)=0.04mol;反应温度T2时,该反应为吸热反应,升高温度,反应速率加快,达到平衡所需时间缩短,且平衡正向移动,平衡时n(S2)>0.04mol,所以曲线图为 ;
;
(2)①据图可知温度越高N2含量越大,而N2O在温度达到一定值继续升高温度含量下降,说明生成N2O的反应为吸热反应,所以△H1>0;由图可知温度低时以反应④为主,说明该反应容易进行,温度高时以反应⑤为主,说明反应⑤具有较高的反应活化能;
②据图可知相同温度的情况下,投料比越大,即氢气的量越多,N2的含量越高,说明增加氢气的量可以增加N2的选择性。

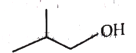
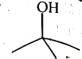
【题目】下面是丁醇的两种同分异构体,其键线式、沸点如表所:
异丁醇 | 叔丁醇 | |
键线式 |
|
|
沸点/℃ | 108 | 82.3 |
下列说法不正确的是( )
A.异丁醇分子是由异丁基、羟基构成的
B.异丁醇的核磁共振氢谱有四组峰,且面积之比是![]()
C.表中沸点数据可以说明烃基结构会明显影响有机物的物理性质
D.异丁醇、叔丁醇在一定条件下经催化氧化可分别生成异丁醛、叔丁醛