题目内容
5.有关铝的几个实验如下.请填写下列空白.实验一 毛刷实验
实验过程如图1.
(1)铝导线与Hg(NO3)2溶液反应的离子方程式为2Al+3Hg2+═2Al3++3Hg.
(2)铝导线放NaOH溶液的目的是除去表面的氧化膜,其化学方程式为Al2O3+2NaOH=2NaAlO2+H2O.
(3)有人认为生成白色毛状物的实质是铝发生电化腐蚀生成A12O3,其中作正极材料的是d
(填序号).
a.O2 b.A1 c.Hg(NO3)2 d.Hg
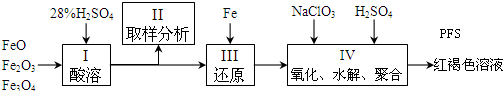
实验二 探究白色毛状物是否含有结晶水取适量白色毛状物样品放入仪器X称量,质量为m1g
(4)图2中仪器X应选用以下哪个装置坩埚(填名称).
(5)上述过程中“冷却“时要在图3所示的装置中进行的原因是防止在冷却过程中吸收空气中的水.
(6)根据所得实验资料,能说明白色毛状物含结晶水的证据是m2>m3(用代数式表示).
实验三 验证A12O3对石蜡油裂解的催化作用
按图4连好装置,检查装置的气密性,加入5~6gAl2O3,加热到500℃左右,往Al2O3上滴入石蜡油.已知:石蜡油为液态烷烃混合物(与汽油类似),沸点164~223℃.一定条件下,其裂解产物为乙烯和烷烃的混合物.
(7)使用装置B的目的是将挥发出来的石蜡油冷却,防止对溴水进行萃取,干扰乙烯的检验.
(8)需要再补充一个实验才能证明Al2O3对石蜡油裂解反应有催化作用,请简述其实验方案:不加氧化铝进行上述实验,若溴水不褪色(或褪色时间较长),则证明氧化铝对石蜡的裂解有催化作用.
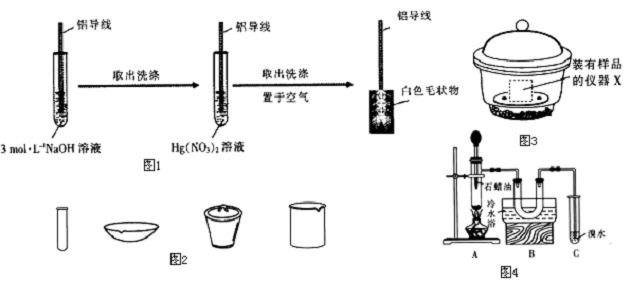
分析 (1)根据铝比汞活泼,所以铝与硝酸汞置换生成汞;
(2)氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水;
(3)铝与硝酸汞置换生成汞,汞、Al与电解质溶液形成原电池,活泼性弱的金属作正极;
(4)灼烧固体在坩埚中进行;
(5)为了防止固体吸收空气中的水,一般在干燥器中冷却;
(6)加热前后固体的质量不同,说明固体中含有结晶水;
(7)石蜡受热有部分挥发,挥发的石蜡会干扰乙烯的检验;
(8)加氧化铝或不加氧化铝,两种情况下作对比实验.
解答 解:(1)因为铝比汞活泼,所以铝与硝酸汞置换生成汞,离子方程式为:2Al+3Hg2+═2Al3++3Hg,故答案为:2Al+3Hg2+═2Al3++3Hg;
(2)氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,其反应的方程式为:Al2O3+2NaOH=2NaAlO2+H2O,故答案为:Al2O3+2NaOH=2NaAlO2+H2O;
(3)铝与硝酸汞置换生成汞,汞、Al与电解质溶液形成原电池,活泼性弱的金属作正极,则正极为汞,故答案为:d;
(4)把固体样品放入仪器中灼烧,灼烧固体在坩埚中进行,故答案为:坩埚;
(5)灼烧后的固体应该放在干燥器中冷却,以防止固体吸收空气中的水,故答案为:防止在冷却过程中吸收空气中的水;
(6)加热前后固体的质量不同,说明加热时固体失去了结晶水,即m2>m3,则说明固体中含有结晶水,故答案为:m2>m3;
(7)已知石蜡油为液态烷烃混合物(与汽油类似),沸点164~223℃,而石蜡的分解温度为500℃左右,反应温度高于石蜡的沸点,则会有部分石蜡挥发,挥发的石蜡,进入溴水会发生萃取,而使溴水褪色,因此会干扰乙烯的检验,所以用冷水冷却挥发出来的石蜡;
故答案为:将挥发出来的石蜡油冷却,防止对溴水进行萃取,干扰乙烯的检验;
(8)要证明Al2O3对石蜡油裂解反应有催化作用,应该在加氧化铝或不加氧化铝,两种情况下作对比实验,不加氧化铝进行上述实验,若溴水不褪色(或褪色时间较长),则证明氧化铝对石蜡的裂解有催化作用,
故答案为:不加氧化铝进行上述实验,若溴水不褪色(或褪色时间较长),则证明氧化铝对石蜡的裂解有催化作用.
点评 本题考查了探究物质的组成、原电池原理的应用、物质的性质、催化剂催化作用的探究等,题目涉及的知识点较多,题目综合性强,侧重于考查学生的对基础知识的综合应用能力和实验探究能力.

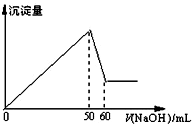 在AlCl3和MgCl2的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中AlCl3与MgCl2的物质的量浓度
在AlCl3和MgCl2的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中AlCl3与MgCl2的物质的量浓度之比为( )
| A. | 1:1 | B. | 3:1 | C. | 1:2 | D. | 2:1 |
| a | 原子核外电子分别占3个不同能级,且每个能级上排布的电子数相同 |
| b | 基态原子的p轨道电子数比s轨道电子数少1 |
| c | 在周期表所列元素中电负性最大 |
| d | 基态原子M层全充满,N层只有一个电子 |
(1)基态c原子核外存在4对自旋相反的电子,其基态原子的价电子排布图为
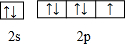 .
.(2)b与其同周期相邻元素第一电离能由大到小的顺序为N>O>C(用元素符号表示).
(3)a元素最高价氧化物对应水化物的酸根离子的空间构型为平面三角形,中心原子的轨道杂化类型为sp3杂化.
(4)c的氢化化极易溶于水,除因为与水分子之间易形成氢键处,还因为氨气与水分子都是极性分子,相似相溶.
(5)d可形成面心立方最密堆积的晶体,若d的相对分子质量为M,密度为ag•cm-3,则d晶胞的体积为$\frac{4M}{{aN}_{A}}$cm3(用M、a表示,阿伏加德罗常数的值用NA表示).
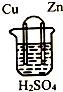
| A. | 铜片作正极,锌片作负极 | |
| B. | 该电池工作时,锌失电子变为Zn2+进入溶液 | |
| C. | 该电池工作时,电子由铜片流向锌片 | |
| D. | 该电池工作时,H+在铜片上得电子被还原生成H2逸出 |
| A. | 原子个数 | B. | 元素种类 | C. | 质量 | D. | 化学键 |
| A. | NaCl水溶液 | B. | NaCl与酒精形成的胶体 | ||
| C. | 黄色的FeCl3溶液 | D. | 无色透明的CCl4液体 |
| 事实 | 非金属性强弱 | |
| A | CH4受热分解的温度比SiH4高 | C>Si |
| B | C与SiO2在高温下反应生成Si和CO | C>Si |
| C | 稀盐酸与Na2SiO3溶液反应生成H2SiO3胶体 | Cl>Si |
| D | H2SO3是中强酸,H2SiO3是弱酸 | S>Si |
| A. | A | B. | B | C. | C | D. | D |
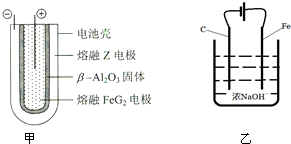 铝、铁是两种重要的金属元素,其单质及化合物在生产生活中的应用日趋广泛.
铝、铁是两种重要的金属元素,其单质及化合物在生产生活中的应用日趋广泛.