题目内容
15. 铝、铁是两种重要的金属元素,其单质及化合物在生产生活中的应用日趋广泛.
铝、铁是两种重要的金属元素,其单质及化合物在生产生活中的应用日趋广泛.(1)①真空碳热还原-氧化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
Al2O3(s)+AlC13(g)+3C(s)═3AlCl(g)+3CO(g)△H=a kJ•mol-1
3AlCl(g)═2Al(l)+AlC13(g)△H=b kJ•mol-1
反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H=(a+b)kJ•mol-1(用含a、b的代数式表示).
②镁铝合金(Mg17Al12)是一种潜在的贮氢材料,可在氩气保护下,将一定物质的量比Mg、Al单质在一定温度下熔炼获得.该合金在一定条件下完全吸氢的反应方程式为:
Mg17Al12+17H2=17MgH2+12Al.
得到的混合物Y(17MgH2+12Al)在一定条件下可释放出氢气.在6.0mol•L-1HCl溶液中,混合物Y能完全释放出H2.1molMg17Al12完全吸氢后得到的混合物Y 与上述盐酸完全反应,释放出H2 的物质的量为52mol.
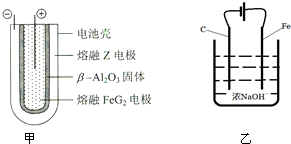
③熔融状态下,Na单质和FeCl3能组成可充电电池(装置示意图如图甲),可充电电池的总反应方程式:2Na+FeCl2$?_{充电}^{放电}$Fe+2NaCl.
(2)聚合硫酸铁(PFS:Fe2(OH)n(SO4)3-0.5n)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理.用铁的氧化物为原料来制取聚合硫酸铁.为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+.实验步骤如下:
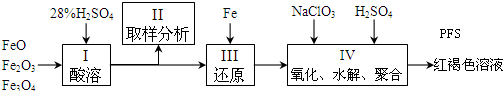
①聚合硫酸铁(PFS)中铁元素的化合价为+3.
②用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有bc.(填序号)
(a)容量瓶 (b)烧杯 (c)玻璃棒
③写出步骤Ⅳ反应的离子方程式:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O.
(3)高铁酸钠(Na3FeO4)广泛应用于净水、电池工业等领域,可设计如图乙装置用电解法制备,原理是Fe+2OH-+2H2O$\frac{\underline{\;电解\;}}{\;}$FeO42-+3H2↑其阳极反应式为:Fe-6e-+8OH-=FeO42-+4H2O.
分析 (1)①依据热化学方程式和盖斯定律计算得到对应反应的焓变;
②该合金在一定条件下完全吸氢的化学方程式为:Mg17Al12+17H2=17MgH2+12Al,1molMg17Al12完全吸氢17mol,在盐酸中会全部释放出来,镁铝合金中的镁和铝都能与盐酸反应生成H2,生成氢气的物质的量分别为17mol、18mol,则生成氢气一共(17+17+12×$\frac{3}{2}$)mol=52mol;
③放电时,为原电池,Fe2+在正极放电生成Fe,;充电时,即为电解质池,电池的负极与外接电源的负极相连;电池的电解质为β-Al2O3,所以可充电电池的总反应方程式:2Na+FeCl2$?_{充电}^{放电}$Fe+2NaCl;
(2)①聚合硫酸铁(PFS)中根据化合价代数和为0,得铁元素的化合价为:$\frac{6-n+n}{2}$=+3价;
②根据配制一定量分数溶液的步骤:计算、称量、溶解,确定所用的仪器;
③第Ⅲ步产生的亚铁离子在酸性条件下与氯酸钠发生氧化还原反应,方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O;
(3)阳极发生氧化反应,化合价升高,所以电极反应式为:Fe-6e-+8OH-=FeO42-+4H2O.
解答 解:(1)①、①Al2O3(s)+AlC13(g)+3C(s)═3AlCl(g)+3CO(g)△H=a kJ•mol-1
②3AlCl(g)=2Al(l)+AlCl3(g);△H=b kJ•mol-1
依据盖斯定律①+②得到:Al2O3(s)+3C(s)=2Al(l)+3CO(g)△H=(a+b)KJ/mol
故答案为:(a+b);
②该合金在一定条件下完全吸氢的化学方程式为:Mg17Al12+17H2=17MgH2+12Al,1molMg17Al12完全吸氢17mol,在盐酸中会全部释放出来,镁铝合金中的镁和铝都能与盐酸反应生成H2,生成氢气的物质的量分别为17mol、18mol,则生成氢气一共(17+17+12×$\frac{3}{2}$)mol=52mol,故答案为:52mol;
③放电时,为原电池,Fe2+在正极放电生成Fe,;充电时,即为电解质池,电池的负极与外接电源的负极相连;电池的电解质为β-Al2O3,所以可充电电池的总反应方程式:2Na+FeCl2$?_{充电}^{放电}$Fe+2NaCl,故答案为:2Na+FeCl2$?_{充电}^{放电}$Fe+2NaCl;
(2)①聚合硫酸铁(PFS)中,根据化合价代数和为0,得铁元素的化合价为:$\frac{6-n+n}{2}$=+3价,故答案为:+3;
②配制一定量分数硫酸溶液需要的仪器有:胶头滴管、量筒、玻璃棒、烧杯,故选:bc;
③第Ⅲ步产生的亚铁离子在酸性条件下与氯酸钠发生氧化还原反应,方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O,故答案为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O; (3)阳极发生氧化反应,化合价升高,所以电极反应式为Fe-6e-+8OH-=FeO42-+4H2O,故答案为:Fe-6e-+8OH-=FeO42-+4H2O.
点评 本题考查盖斯定律的应用和以铁及其化合物为载体,以流程图形式考查了氧化还原反应知识、元素化合物的知识,综合性强,有一定的难度.

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案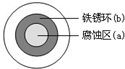
| A. | 液滴中的Cl-由a区向b区迁移 | |
| B. | 液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-→4OH- | |
| C. | 液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH-形成Fe(OH)2,进一步氧化、脱水形成铁锈 | |
| D. | 若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-→Cu2+ |
| A. | 陶瓷的主要成分是碳酸钙 | |
| B. | 用铁容器存放浓盐酸 | |
| C. | 硅是制造半导体的常用材料 | |
| D. | 工业上利用氨气制硝酸属于人工固氮 |
| A. | 1L水中含有1 molMgCl2 | B. | 其中Cl-浓度为2 mol•L-1 | ||
| C. | 溶液中含有1 molMgCl2 | D. | 将95gMgCl2溶于1L水中所得的溶液 |
| A. | Na2O2 | B. | Na2SO4 | C. | Na2CO3 | D. | NaOH |
| A. | 氧化还原反应的本质是元素化合价的升降 | |
| B. | 氧化反应和还原反应必然同时发生 | |
| C. | 氧化反应是指反应中失去电子,所含元素化合价升高,被氧化 | |
| D. | 还原反应在反应中失去电子,所含元素化合价升高,被氧化 |
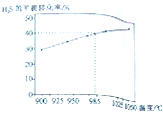 氢气是清洁能源,也是重要的化工原料.
氢气是清洁能源,也是重要的化工原料.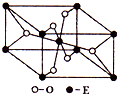 已知A、B、C、D、E五种元素的原子序数依次增大,A元素位于周期表的s区,其原子中电子层数等于未成对电子数;B的基态原子中电子占据三种能量不同的原子轨道,且每种已知轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次增大,A元素位于周期表的s区,其原子中电子层数等于未成对电子数;B的基态原子中电子占据三种能量不同的原子轨道,且每种已知轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.