题目内容
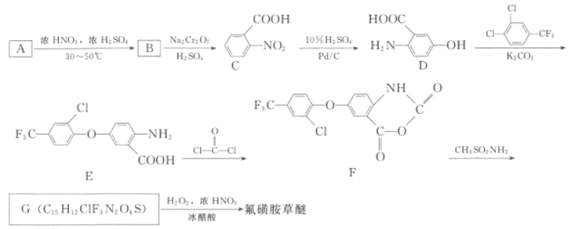
【题目】氟磺胺草醚(结构式为 ,化学式为C13H10ClF3N2O6S)为高效豆田芽后除草剂,在杂草萌生后施药可有效防除一年生阔叶杂草。其合成方法如图:
,化学式为C13H10ClF3N2O6S)为高效豆田芽后除草剂,在杂草萌生后施药可有效防除一年生阔叶杂草。其合成方法如图:
回答下列问题:
(1)已知A的分子式为C7H8,则其结构简式为_______________。
(2)写出从A→B反应的化学方程式:______________________。与B具有相同官能团的B的同分异构体有___________个,其中核磁共振氢谱吸收峰面积比值为2:2:2:1的是___________(写结构简式)
(3)上述反应中,B→C属于___________反应,E→F属于___________反应。
(4)G的结构简式为___________。
(5)仿照题给价息,写出以 和
和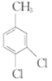 为原料合成
为原料合成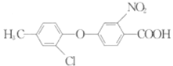 的流程图(其他无机试剂自选)。_________________
的流程图(其他无机试剂自选)。_________________
【答案】![]()
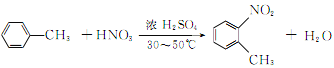 3
3 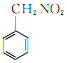 氧化 取代
氧化 取代 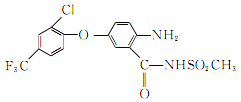
【解析】
A→B是在苯环上引入-NO2,B→C是苯环上的甲基被Na2Cr2O7氧化为-COOH,结合C的结构简式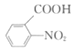 和A的分子式为C7H8,可知A为
和A的分子式为C7H8,可知A为![]() 、B为
、B为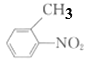 ;C→D是将C中-NO2还原为-NH2,并在-NH2的对位引入酚羟基,D再与
;C→D是将C中-NO2还原为-NH2,并在-NH2的对位引入酚羟基,D再与![]() 发生取代反应生成E,E再和COCl2发生取代反应生成F,F在CH3SO2NH2的作用下发生取代反应生成G,G在H2O2的作用下氧化得到
发生取代反应生成E,E再和COCl2发生取代反应生成F,F在CH3SO2NH2的作用下发生取代反应生成G,G在H2O2的作用下氧化得到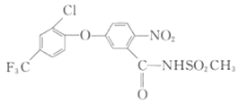 ,结合G的分子组成C15H2ClF3N2O4S,可推断出G的结构简式为
,结合G的分子组成C15H2ClF3N2O4S,可推断出G的结构简式为 ,据此分析解题。
,据此分析解题。
(1)由分析可知A为甲苯,其结构简式为![]() ;(2)A→B是甲苯与浓硫酸、浓硝酸混合加热发生硝化反应生成邻硝基甲苯,发生反应的化学方程式为
;(2)A→B是甲苯与浓硫酸、浓硝酸混合加热发生硝化反应生成邻硝基甲苯,发生反应的化学方程式为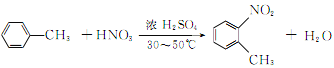 ;B的结构简式为
;B的结构简式为 ,其中硝基和甲基有邻、间及对位三种,另外硝基还可能连接在甲基上,则与B具有相同官能团的B的同分异构体有3个,其中
,其中硝基和甲基有邻、间及对位三种,另外硝基还可能连接在甲基上,则与B具有相同官能团的B的同分异构体有3个,其中 有四种等效氢且核磁共振氢谱吸收峰面积比值为2:2:2:1;(3)B→C是苯环上的甲基被Na2Cr2O7氧化为-COOH,属于氧化反应,E→F是E和COCl2发生取代反应生成F;(4)由分析可知G的结构简式为
有四种等效氢且核磁共振氢谱吸收峰面积比值为2:2:2:1;(3)B→C是苯环上的甲基被Na2Cr2O7氧化为-COOH,属于氧化反应,E→F是E和COCl2发生取代反应生成F;(4)由分析可知G的结构简式为 ;(5)
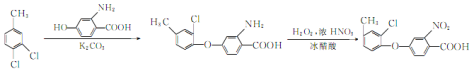
;(5)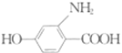 和
和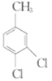 在K2CO3的作用下发生取代反应生成
在K2CO3的作用下发生取代反应生成![]() ,再利用酸性条件下的H2O2将-NH2氧化为-NO2,即得到
,再利用酸性条件下的H2O2将-NH2氧化为-NO2,即得到![]() ,具体合成流程图为
,具体合成流程图为 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案