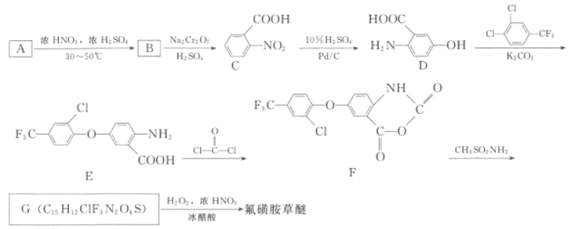
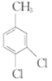
题目内容
【题目】下列关于含氮化合物的性质叙述正确的是( )
A.可用铁制容器储存稀硝酸
B.实验室用排空气集气法收集NO气体
C.实验室可用氨水与硫酸铝溶液反应制取氢氧化铝
D.NO2与水发生化合反应生成硝酸
【答案】C
【解析】
A. 可用铁制容器储存浓硝酸,稀硝酸和铁反应,浓硝酸和铁常温钝化,故A错误;
B. 实验室收集NO气体不能用排空气集气法,NO和O2反应,故B错误;
C. 实验室可用氨水与硫酸铝溶液反应制取氢氧化铝,故C正确;
D. NO2与水反应生成硝酸,但不是发生化合反应,故D错误。
综上所述,答案为C。

 名校课堂系列答案
名校课堂系列答案【题目】为了防止氮氧化物对空气的污染,人们采取了很多措施。
(1)如用CH4催化还原NO2可以消除氮氧化物的污染,发生的反应如下: CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) △H=-867 kJ·mol-1。
N2(g)+CO2(g)+2H2O(g) △H=-867 kJ·mol-1。
①下列有关说法正确的是_________。
A.在容器中充入1mol CH4和2 mol NO2,当体系中n(CH4)/n(NO2)比值不随时间变化时,反应达到平衡状态
B.恒温恒容时,当混合气体的密度不随时间变化时,该反应达到平衡状态
C.体系达到平衡后,升高温度,体系中的混合气体的平均相对分子质量增大
D.恒温恒压时,充入CH4有利于提高氮氧化物的转化率
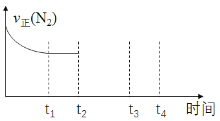
②在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态。请在右图中补充画出从t2到t4时刻v正(N2) 随时间的变化曲线:____________
(2)现有的汽车尾气处理的原理是:NO(g)+2CO(g)![]() N2(g) +2CO2(g),通常使含适当比例的NO、CO尾气通过装有高效催化剂的处理装置。请根据以下相关数据,分析仅使用催化剂能否有效消除NO、CO尾气污染___________。
N2(g) +2CO2(g),通常使含适当比例的NO、CO尾气通过装有高效催化剂的处理装置。请根据以下相关数据,分析仅使用催化剂能否有效消除NO、CO尾气污染___________。
反应 | 25℃时的平衡常数 | 焓变 |
反应I:2NO(g) | K1=1×1030 | △H=-180.5kJ/mol |
反应II:2CO2 (g) | K2=4×10-92 | △H= +566.0kJ/mol |
(3)用NH3催化还原NOx也可以消除氮氧化物的污染,其反应原理为:NO(g) +NO2(g)+2NH3(g)![]() 2N2(g) + 3H2O(g)。一定温度下,在某恒定压强为P的密闭容器中充入一定量的NO、NO2和NH3,达到平衡状态后,容器中含n(NO)=a mol,n(NO2)=2a mol,n(NH3)=2a mol,n(N2)=2b mol,且N2(g)的体积分数为1/3,请计算此时的平衡常数Kp=________________。(用只含P的式子表示,且化至最简式)。(备注:对于有气体参加的反应,可用某组分的平衡分压代替物质的量浓度计算平衡常数,记作KP。如p(NO2)为NO2的平衡分压,p(NO2)=x(NO2)p,p为平衡总压,x(NO2)为平衡体系中NO2的物质的量分数。)
2N2(g) + 3H2O(g)。一定温度下,在某恒定压强为P的密闭容器中充入一定量的NO、NO2和NH3,达到平衡状态后,容器中含n(NO)=a mol,n(NO2)=2a mol,n(NH3)=2a mol,n(N2)=2b mol,且N2(g)的体积分数为1/3,请计算此时的平衡常数Kp=________________。(用只含P的式子表示,且化至最简式)。(备注:对于有气体参加的反应,可用某组分的平衡分压代替物质的量浓度计算平衡常数,记作KP。如p(NO2)为NO2的平衡分压,p(NO2)=x(NO2)p,p为平衡总压,x(NO2)为平衡体系中NO2的物质的量分数。)
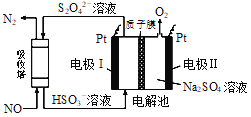
(4)用间接电化学法对大气污染物NO进行无害化处理,其原理示意如图(质子膜允许H+和H2O通过),电极I发生的电极反应为_________________________。