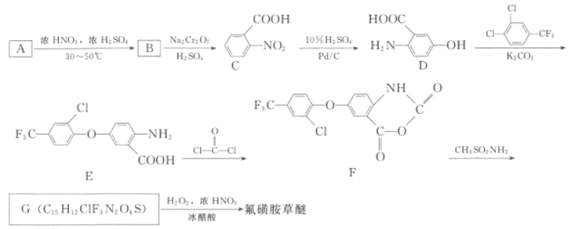
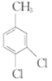
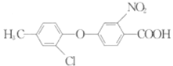
题目内容
【题目】氯化亚铜(CuCl)可用作催化剂、杀菌剂、媒染剂、脱色剂。CuCl是一种白色粉末,微溶于水、不溶于乙醇,在潮湿的空气中易被氧化。实验室采用如图装置和下列步骤制备氯化亚铜。
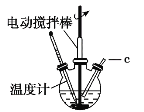
步骤1:在三颈烧瓶中加入20%盐酸、食盐、铜屑,加热至60~70℃,开动搅拌器,同时从c口缓慢通入氧气,制得Na[CuCl2]溶液。
步骤2:反应完全后,冷却,过滤,滤液用适量的水稀释,析出CuCl。
步骤3:过滤,分别用盐酸、乙醇洗涤滤出的固体。
步骤4:在真空干燥器中60~70 ℃干燥2h,冷却后得到产品。
回答下列问题:
(1)质量分数为20%的盐酸密度为1.1g/cm3,物质的量浓度为___________;配制20%盐酸需要的玻璃仪器有:__________、烧杯、玻璃棒、胶头滴管。
(2)步骤1中制得Na[CuCl2]的化学方程式为________________________________。
(3)根据“步骤2中用水稀释滤液能得到CuCl”推测,滤液中存在的平衡是____________。
(4)析出的CuCl晶体不用水而用盐酸、乙醇分别洗涤的目的是__________________。
(5)测定产品中氯化亚铜的质量分数,实验过程如下:
准确称取制备的氯化亚铜产品0.25 g,将其置于足量的FeCl3溶液中,待样品全部溶解后,加入适量稀硫酸,用0.10 mol/L的硫酸铈[Ce(SO4)2]标准溶液滴定到终点,消耗硫酸铈溶液24.50 mL,反应中Ce4+被还原为Ce3+。(已知:CuCl+FeCl3=CuCl2+FeCl2)
①硫酸铈标准溶液应盛放在________(填“酸”或“碱”)式滴定管中。
②产品中氯化亚铜的质量分数为________。
【答案】6.0mol/L 量筒 4HCl(浓)+4NaCl+4Cu+O2![]() 4Na[CuCl2]+2H2O [CuCl2]-(aq)
4Na[CuCl2]+2H2O [CuCl2]-(aq) ![]() CuCl(s)+Cl-(aq) 用盐酸洗涤可以减小溶解导致的损失;用乙醇洗涤可以使晶体迅速干燥,避免CuCl被氧化 酸 97.51%
CuCl(s)+Cl-(aq) 用盐酸洗涤可以减小溶解导致的损失;用乙醇洗涤可以使晶体迅速干燥,避免CuCl被氧化 酸 97.51%
【解析】
(1)根据物质的量浓度与质量分数换算关系可得该溶液的物质的量浓度为c=![]() ;配制20%盐酸,由于溶质为液体,所以需要的玻璃仪器有:量筒、烧杯、玻璃棒、胶头滴管;
;配制20%盐酸,由于溶质为液体,所以需要的玻璃仪器有:量筒、烧杯、玻璃棒、胶头滴管;
(2)根据步骤I所述可知:NaCl、HCl、Cu、O2在加热时服用产生Na[CuCl2],同时产生H2O,根据原子守恒、电子守恒,可得反应的化学方程式为:4HCl(浓)+4NaCl+4Cu+O2![]() 4Na[CuCl2]+2H2O;
4Na[CuCl2]+2H2O;
(3)步骤2操作是反应完全后,冷却,过滤,滤液用适量的水稀释,析出CuCl,说明[CuCl2]-在溶液中存在电离平衡:[CuCl2]-(aq)![]() CuCl(s)+Cl-(aq),加水稀释,平衡正向移动,[CuCl2]-转化为CuCl沉淀;
CuCl(s)+Cl-(aq),加水稀释,平衡正向移动,[CuCl2]-转化为CuCl沉淀;
(4)析出的CuCl晶体不用水而用盐酸、乙醇洗涤,是因为用盐酸洗涤可以减小溶解导致的损失;用乙醇洗涤是利用乙醇容易挥发的特性,可以使晶体迅速干燥,避免CuCl被氧化;
(5)硫酸铈是强酸弱碱盐,水解使溶液显酸性,所以应该盛放在酸式滴定管中;
根据反应前后电子转移数目相等,可得关系式:CuCl~FeCl2~Ce(SO4)2,n(CuCl)=n[Ce(SO4)2]= 0.10 mol/L×0.0245L=0.00245mol,m(CuCl)= 0.00245mol×99.5g/mol=0.244g,所以产品中氯化亚铜的质量分数为(0.244g÷0.25 g) ×100%=97.51%。