题目内容
【题目】CO2等温室气体的排放所带来的温室效应已经对人类的生存环境产生很大影响。CO2的利用也成为人们研究的热点。以CO2和H2为原料合成甲醇技术获得应用。
(1)已知CH3OH (g)+![]() O2(g)===CO2(g)+2H2O(l ) △H1=-363 kJ/mol
O2(g)===CO2(g)+2H2O(l ) △H1=-363 kJ/mol
2H2(g)+O2(g)===2H2O(1) △H2=-571.6kJ/mol
H2O(1)====H2O(g) △H3=+44 kJ/ mol
则CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的反应热△H=___________。
CH3OH(g)+H2O(g)的反应热△H=___________。
(2)该反应常在230~280℃、1.5MPa条件下进行。采用催化剂主要组分为CuO-ZnO-Al2O3。催化剂活性组分为单质铜,因此反应前要通氢气还原。写出得到活性组分的反应的化学方程式:__________________________________________。使用不同催化剂时,该反应反应热△H__________(填“相同”或“不同”)
(3)该反应可以看作以下两个反应的叠加:
CO2(g)+H2(g)![]() CO(g)+H2O(g),平衡常数K1;
CO(g)+H2O(g),平衡常数K1;
CO(g)+2H2(g)![]() CH3OH(g),平衡常数K2;
CH3OH(g),平衡常数K2;
则CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的平衡常数K=___________(用含K1、K2的代数式表示)
CH3OH(g)+H2O(g)的平衡常数K=___________(用含K1、K2的代数式表示)
(4)反应过程中,发现尾气中总会含有一定浓度的CO,为了减少其浓度,可以采取的措施为_________________________________(写一条即可)
(5)为了提高反应速率,采取的措施可以有___________。
A.使用高效催化剂 B.在较高压强下进行 C.降低压强 D.充入高浓度CO2
(6)有人研究了用电化学方法把CO2转化为CH3OH,其原理如图所示:
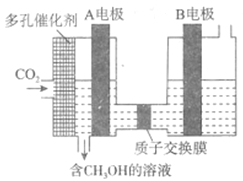
则图中A电极接电源___________极。已知B电极为惰性电极,则在水溶液中,该极的电极反应为______________________。
【答案】-450.4kJ/mol H2+CuO![]() Cu+H2O 相同 K1K2 增大氢气的浓度、分离出甲醇或水蒸气等(合理即可) ABD 负 2H2O-4e-=4H++O2↑
Cu+H2O 相同 K1K2 增大氢气的浓度、分离出甲醇或水蒸气等(合理即可) ABD 负 2H2O-4e-=4H++O2↑
【解析】
(1)已知①CH3OH (g)+![]() O2(g)===CO2(g)+2H2O(l ) △H1=-363 kJ/mol、②2H2(g)+O2(g)===2H2O(1) △H2=-571.6kJ/mol、③H2O(1)====H2O(g) △H3=+44 kJ/ mol,根据盖斯定律可知,②×
O2(g)===CO2(g)+2H2O(l ) △H1=-363 kJ/mol、②2H2(g)+O2(g)===2H2O(1) △H2=-571.6kJ/mol、③H2O(1)====H2O(g) △H3=+44 kJ/ mol,根据盖斯定律可知,②×![]() +③-①可得CO2(g)+3H2(g)
+③-①可得CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),则CO2(g)+3H2(g)
CH3OH(g)+H2O(g),则CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的反应热△H=(-571.6kJ/mol)×
CH3OH(g)+H2O(g)的反应热△H=(-571.6kJ/mol)×![]() +(+44 kJ/ mol)-(-363 kJ/mol)=-450.4kJ/mol;(2)催化剂活性组分为单质铜,并且反应前要通氢气还原,说明氢气还原氧化铜生成铜和水,发生反应的化学方程式为H2+CuO
+(+44 kJ/ mol)-(-363 kJ/mol)=-450.4kJ/mol;(2)催化剂活性组分为单质铜,并且反应前要通氢气还原,说明氢气还原氧化铜生成铜和水,发生反应的化学方程式为H2+CuO![]() Cu+H2O;使用不同催化剂时,能改变反应的活化能,但不改变反应的热效应,即该反应反应热△H相同;(3)已知反应:①CO2(g)+H2(g)
Cu+H2O;使用不同催化剂时,能改变反应的活化能,但不改变反应的热效应,即该反应反应热△H相同;(3)已知反应:①CO2(g)+H2(g)![]() CO(g)+H2O(g),平衡常数K1;②CO(g)+2H2(g)
CO(g)+H2O(g),平衡常数K1;②CO(g)+2H2(g)![]() CH3OH(g),平衡常数K2;由盖斯定律可知,①+②可得总反应CO2(g)+3H2(g)
CH3OH(g),平衡常数K2;由盖斯定律可知,①+②可得总反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),则总反应的平衡常数等于分反应的平衡常数之积,则K=K1K2;(4)反应过程中,发现尾气中总会含有一定浓度的CO,为了减少其浓度,可以设法让平衡CO(g)+2H2(g)
CH3OH(g)+H2O(g),则总反应的平衡常数等于分反应的平衡常数之积,则K=K1K2;(4)反应过程中,发现尾气中总会含有一定浓度的CO,为了减少其浓度,可以设法让平衡CO(g)+2H2(g)![]() CH3OH(g)向正反应方向移动,可采取的措施有:增大氢气的量、分离出CH3OH(g) 或水蒸气等,促进反应②平衡正向移动,提高CO的利用率即可;(5)A.使用高效催化剂可提高反应速率,故A正确;B.增大压强,可提高反应速率,故B正确;C.降低压强,反应速率减慢,故C错误;D.充入高浓度CO2,可提高反应速率,故D正确;故答案为ABD;(6)CO2转化为CH3OH发生还原反应,说明A电极为阴极,连接电源的负极,B为阳极,发生氧化反应,电极反应式为2H2O-4e-=4H++O2↑。
CH3OH(g)向正反应方向移动,可采取的措施有:增大氢气的量、分离出CH3OH(g) 或水蒸气等,促进反应②平衡正向移动,提高CO的利用率即可;(5)A.使用高效催化剂可提高反应速率,故A正确;B.增大压强,可提高反应速率,故B正确;C.降低压强,反应速率减慢,故C错误;D.充入高浓度CO2,可提高反应速率,故D正确;故答案为ABD;(6)CO2转化为CH3OH发生还原反应,说明A电极为阴极,连接电源的负极,B为阳极,发生氧化反应,电极反应式为2H2O-4e-=4H++O2↑。