题目内容
17.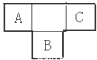 A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等
A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等(1)写出元素的符号:AN、BS、CF;
(2)B元素位于元素周期表中第三周期,第ⅥA族.
(3)C的原子结构示意图为
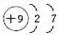 ,用电子式表示C的单质与H2反应的过程:
,用电子式表示C的单质与H2反应的过程: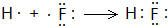 .
.(4)由元素A、C及氢元素形成的化合物中含有的化学键的类型有离子键、共价键.
分析 A、B、C为短周期元素,由元素所处位置可知,A、C处于第二周期,B处于第三周期,设B元素的质子数为x,则A的核外电子数为x-9,C的核外电子数为x-7,可得x-9+x-7=x,解之得x=16,所以A的质子数为7,B的质子数为16,C的质子数为9,则A、B、C分别为N、S、F元素,据此解答.
解答 解:A、B、C为短周期元素,由元素所处位置可知,A、C处于第二周期,B处于第三周期,设B元素的质子数为x,则A的核外电子数为x-9,C的核外电子数为x-7,可得x-9+x-7=x,解之得x=16,所以A的质子数为7,B的质子数为16,C的质子数为9,则A、B、C分别为N、S、F元素,
(1)由上述分析可知,A、B、C分别为N、S、F元素,故答案为:N;S;F;
(2)B元素的原子核内质子数为16,原子核外有3个电子层,最外层电子数为6,位于元素周期表第三周期ⅥA族,故答案为:三;ⅥA;
(3)C的原子序数为9,原子核外有2个电子层,最外层电子数为7,原子结构示意图为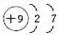 ,F2与H2反应生成HF,HF属于共价化合物,原子之间形成1对共用电子对,用电子式表示形成过程为
,F2与H2反应生成HF,HF属于共价化合物,原子之间形成1对共用电子对,用电子式表示形成过程为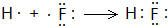 ,
,
故答案为: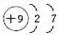 ;
;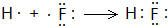 ;
;
(4)由元素N、F及氢元素形成的化合物为NH4F,含有离子键、共价键,故答案为:离子键、共价键.
点评 本题考查位置结构性质关系的综合应用,难度不大,根据同主族元素原子序数关系推断元素是关键,熟练掌握元素周期表的结构.

练习册系列答案
相关题目
8.X、Y都是短周期元素,X原子最外层只有一个电子,Y元素的最高正价与最低负价的代数和为6,X和Y两元素形成的化合物为R,则下列关于R的叙述正确的是( )
| A. | R一定是共价化合物 | |
| B. | R一定是离子化合物 | |
| C. | R可能是共价化合物,也可能是离子化合物 | |
| D. | R是HCl |
12.下列气体溶于水后,所得溶液能使无色酚酞溶液变红的物质是( )
| A. | NO2 | B. | HCl | C. | SO2 | D. | NH3 |
2.下列关于有机物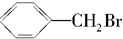 的说法不正确的是( )
的说法不正确的是( )
 的说法不正确的是( )
的说法不正确的是( )| A. | 所有的碳原子在同一个平面上 | |
| B. | 能够发生加成反应 | |
| C. | 不能发生消去反应 | |
| D. | 水解生成的有机物可与NaOH溶液反应 |