题目内容
9.写出Si、P、S、Cl的氢化物的化学式SiH4、PH3、H2S、HCl,它们的稳定性依次SiH4<PH3<H2S<HCl,可以从非金属与氢气化合反应,生成气态氢化物的难易程度,或者气态氢化物的热稳定性,或者非金属之间的置换反应,推测非金属之间的活泼程度Si、P、S、Cl的活泼型顺序为Si<P<S<Cl,或者说非金属性逐渐增强.分析 Si、P、S、Cl的最低价分别为-4价、-3价、-2价、-1价,与H化合生成氢化物,非金属性越强,氢化物越稳定,与氢气化合越容易,越容易发生置换反应,以此来解答.
解答 解:Si、P、S、Cl的最低价分别为-4价、-3价、-2价、-1价,则氢化物的化学式分别为SiH4、PH3、H2S、HCl,非金属性Si<P<S<Cl,稳定性依次为SiH4<PH3<H2S<HCl,可以从非金属与氢气化合反应,生成气态氢化物的难易程度,或者气态氢化物的热稳定性,或者非金属之间的置换反应,推测非金属之间的活泼程度Si、P、S、Cl的活泼型顺序为Si<P<S<Cl,或者说非金属性逐渐增强,
故答案为:SiH4、PH3、H2S、HCl;SiH4<PH3<H2S<HCl;氢气化合;气态氢化物;气态氢化物;置换;Si<P<S<Cl;增强.
点评 本题考查元素周期律和元素周期表的应用,为高频考点,把握同周期非金属性比较为解答的关键,注意非金属性比较的方法和规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
14.将20gM物质、5gN物质、9gR物质混合加热发生化学反应,经充分反应后的混合物中含5gM物质、20gR物质还含有一种新物质Q.若M、N、R、Q的相对分子质量分别为30、20、44、18,它们之间发生反应的化学方程式是( )
| A. | M+N=Q+R | B. | M+2N=2R+Q | C. | 2M+N=2R+Q | D. | 2M+N=R+2Q |
20.下列说法不正确的是( )
| A. | (CH3)2C(Cl)CH2CH3的名称为:2-氯-2-甲基丁烷 | |
| B. | 某烷烃主链含4个碳原子的结构有2种,则与其碳原子个数相同且主链有4个碳原子的单烯烃有4种 | |
| C. | 1mol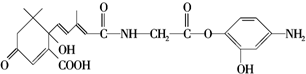 与NaOH溶液反应,最多消耗5molNaOH 与NaOH溶液反应,最多消耗5molNaOH | |
| D. | 1molβ-紫罗兰酮(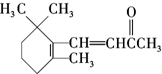 )与1molBr2发生加成反应得到3种不同产物 )与1molBr2发生加成反应得到3种不同产物 |
4.下列不属于可逆反应的是( )
| A. | Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O | |
| B. | 2SO2+O2$?_{△}^{催化剂}$2SO3 | |
| C. | Cl2+H2O?HCl+HClO | |
| D. | 2NO2?N2O4 |
14.在120℃条件下,1mL气态混合物与10mLO2混合后点燃,最终测得气体的总体积为11mL.则该气态混合物可能是( )
| A. | C2H4、C6H6 | B. | CH4、CH2O | C. | C3H8、CH3CH2OH | D. | C2H6、CH3CHO |
1. 如图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压胶管的胶头,下列与实验事实不相符的是( )
如图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压胶管的胶头,下列与实验事实不相符的是( )
 如图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压胶管的胶头,下列与实验事实不相符的是( )
如图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压胶管的胶头,下列与实验事实不相符的是( )| A. | NH3(H2O含石蕊) 蓝色喷泉 | B. | Cl2(饱和食盐水) 无色喷泉 | ||
| C. | HCl (H2O含石蕊) 红色喷泉 | D. | SO2(NaOH溶液) 无色喷泉 |
19.如图,铝电池(甲)性能优越,现用该电池给乙装置进行电解,以制备一种“绿色高效多功能”水处理剂,下列说法错误的是( )


| A. | 甲装置工作时,正极发生发应为3AgO+6e-+3H2O=3Ag+6OH-; | |
| B. | 若乙装置选用阴离子交换膜时,则电解完成后,右侧溶液中含有FeO42-; | |
| C. | 每制得1mol Na2FeO4,理论上甲装置中消耗2mol NaOH; | |
| D. | 乙装置若选用阴离子交换膜,电解一段时间后,右侧溶液PH下降(忽略溶液体积改变). |
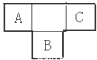 A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等
A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等 ,用电子式表示C的单质与H2反应的过程:
,用电子式表示C的单质与H2反应的过程: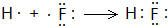 .
. .
.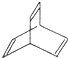 ,X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有2种.有机物Y是X的同分异构体,且属于芳香烃,写出Y的结构简式:
,X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有2种.有机物Y是X的同分异构体,且属于芳香烃,写出Y的结构简式: .
.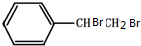 .
.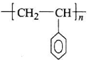 .
.