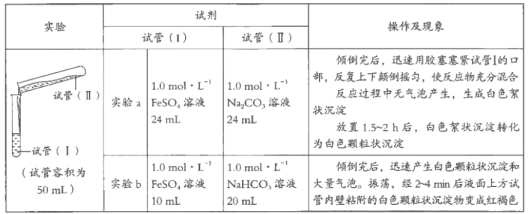
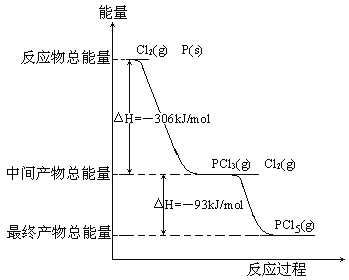
题目内容
【题目】铝、氧化铝、氢氧化铝等在工业上用途广泛。
(1)用原子结构知识解释Al的金属性比Na弱:Al与Na在元素周期表中位于同一周期,_________________,Al的金属性比Na弱。
(2)结合化学用语,用化学平衡知识解释,氢氧化铝既溶于强酸溶液,又溶于强碱溶液:_______________________。
(3)Al2O3是制备二甲醚(CH3OCH3)的反应中的重要催化剂。
已知由H2、CO制备二甲醚过程为:
CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.1 kJ·mol-1
2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH2=-24.5 kJ·mol-1
写出由H2、CO制备二甲醚的总的热化学方程式____________。
工业上以铝土矿(主要成分是氧化铝,含氧化铁、氧化镁、二氧化硅、氧化铜等杂质)为原料提取铝、氧化铝、氢氧化铝的无机化工流程如图:
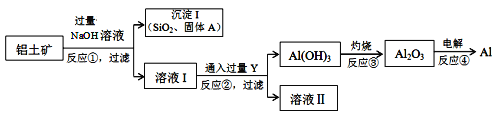
[已知:该条件下NaOH溶液与二氧化硅反应非常缓慢,在工业生产时不必考虑]
(4)固体A为________________________________。
(5)写出反应②的离子方程式为___________________________。
(6)反应④所得的铝材中,往往含有少量的铁和硅等杂质,可用电解精炼法进一步提纯,该电解池中阳极的电极反应式为__________________,下列可作阴极材料的是 ______
A.铝材 B.石墨 C.纯铝 D.铅板
(7)铝土矿中Al2O3的含量为40.8%,要使1t铝土矿中的Al2O3全部溶解理论上至少需要NaOH的质量为________t。
【答案】核电荷数Al〉Na,原子半径Al〈Na,失电子能力Al〈Na Al(OH)3在水中存在如下平衡:AlO2-+H++H2O ![]() Al(OH)3
Al(OH)3![]() Al3++3OH-遇强酸时,Al(OH)3电离出的OH-被中和,使溶液中c(OH-)降低,平衡右移;遇强碱时,Al(OH)3电离出的H+被中和,使溶液中c(H+)降低,平衡左移。所以,氢氧化铝既溶于强酸溶液,又溶于强碱溶液。 2CO(g)+4H2(g)= CH3OCH3(g)+H2O(g) ΔH=-204.7 kJ·mol-1 Fe2O3、MgO、CuO AlO2- + CO2 +2H2O === Al(OH)3↓ + HCO3- Al-3e-=== Al3+ C 0.32 t
Al3++3OH-遇强酸时,Al(OH)3电离出的OH-被中和,使溶液中c(OH-)降低,平衡右移;遇强碱时,Al(OH)3电离出的H+被中和,使溶液中c(H+)降低,平衡左移。所以,氢氧化铝既溶于强酸溶液,又溶于强碱溶液。 2CO(g)+4H2(g)= CH3OCH3(g)+H2O(g) ΔH=-204.7 kJ·mol-1 Fe2O3、MgO、CuO AlO2- + CO2 +2H2O === Al(OH)3↓ + HCO3- Al-3e-=== Al3+ C 0.32 t
【解析】
(1)同一周期元素从左到右,原子半径逐渐减小,失电子能力逐渐减弱,金属性逐渐减弱;
(2) Al(OH)3在水中存在如下平衡:AlO2-+H++H2O ![]() Al(OH)3
Al(OH)3![]() Al3++3OH-遇强酸时,Al(OH)3电离出的OH-被中和,使溶液中c(OH-)降低,平衡右移;遇强碱时,Al(OH)3电离出的H+被中和,使溶液中c(H+)降低,平衡左移;
Al3++3OH-遇强酸时,Al(OH)3电离出的OH-被中和,使溶液中c(OH-)降低,平衡右移;遇强碱时,Al(OH)3电离出的H+被中和,使溶液中c(H+)降低,平衡左移;
(3) 根据盖斯定律,结合所给反应热化学方程式解答;
(4)~(7)由题给信息可以知道,铝土矿加入过量NaOH溶液可将铝与其它杂质分离,结合“NaOH溶液与二氧化硅反应非常缓慢,在工业生产时不必考虑”可以知道,所得固体A含有SiO2、Fe2O3、MgO、CuO,滤液Ⅰ含有NaAlO2,通入过量Y生成氢氧化铝沉淀,则Y为CO2,滤液Ⅱ为NaHCO3溶液,灼烧氢氧化铝生成氧化铝,电解熔融的氧化铝可生成Al,以此解答。
(1)Al与Na在元素周期表中位于同一周期,核电荷数Al〉Na,原子半径Al〈Na,失电子能力Al〈Na,所以Al的金属性比Na弱;
因此,本题正确答案是:核电荷数Al〉Na,原子半径Al〈Na,失电子能力Al〈Na;
(2)Al(OH)3在水中存在如下平衡:AlO2-+H++H2O ![]() Al(OH)3
Al(OH)3![]() Al3++3OH-遇强酸时,Al(OH)3电离出的OH-被中和,使溶液中c(OH-)降低,平衡右移;遇强碱时,Al(OH)3电离出的H+被中和,使溶液中c(H+)降低,平衡左移。所以,氢氧化铝既溶于强酸溶液,又溶于强碱溶液;
Al3++3OH-遇强酸时,Al(OH)3电离出的OH-被中和,使溶液中c(OH-)降低,平衡右移;遇强碱时,Al(OH)3电离出的H+被中和,使溶液中c(H+)降低,平衡左移。所以,氢氧化铝既溶于强酸溶液,又溶于强碱溶液;
因此,本题正确答案是:Al(OH)3在水中存在如下平衡:AlO2-+H++H2O ![]() Al(OH)3
Al(OH)3![]() Al3++3OH-遇强酸时,Al(OH)3电离出的OH-被中和,使溶液中c(OH-)降低,平衡右移;遇强碱时,Al(OH)3电离出的H+被中和,使溶液中c(H+)降低,平衡左移。所以,氢氧化铝既溶于强酸溶液,又溶于强碱溶液;
Al3++3OH-遇强酸时,Al(OH)3电离出的OH-被中和,使溶液中c(OH-)降低,平衡右移;遇强碱时,Al(OH)3电离出的H+被中和,使溶液中c(H+)降低,平衡左移。所以,氢氧化铝既溶于强酸溶液,又溶于强碱溶液;
(3)根据盖斯定律:第一个反应式×2+第二个反应得出:2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g)△H=(-90.1×2-24.5)kJ·mol-1=-204.7kJ·mol-1。
因此,本题正确答案是:2CO(g)+4H2(g)= CH3OCH3(g)+H2O(g) ΔH=-204.7 kJ·mol-1 ;
(4)由分析可以知道固体A为Fe2O3、MgO、CuO,
因此,本题正确答案是:Fe2O3、Mg、CuO;
(5)反应②为偏铝酸钠与过量二氧化碳的反应,生成氢氧化铝沉淀和碳酸氢钠,反应的离子方程式为AlO2- + CO2 +2H2O === Al(OH)3↓ + HCO3-,
因此,本题正确答案是:AlO2- + CO2 +2H2O === Al(OH)3↓ + HCO3-;
(6)在电解池中阳极发生氧化反应,金属失去电子,电极反应式为Al-3e-=== Al3+,电解精炼铝应以纯铝作阴极材料,故选C,
因此,本题正确答案是:Al-3e-=== Al3+;C;
(7)铝土矿中Al2O3的含量为40.8%,1t铝土矿中的Al2O3的物质的量为![]() =4000mol,与氢氧化钠溶液发生Al2O3+2NaOH=2NaAlO2+H2O,由方程式可以知道需要8000molNaOH,质量为
=4000mol,与氢氧化钠溶液发生Al2O3+2NaOH=2NaAlO2+H2O,由方程式可以知道需要8000molNaOH,质量为![]() =0.32t,
=0.32t,
因此,本题正确答案是:0.32t。

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案【题目】一定条件下,下列各组物质能一步实现图中所示转化关系的是
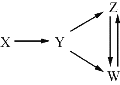
选项 | X | Y | Z | W |
A | Al | Al2O3 | NaAlO2 | Al(OH)3 |
B | Fe3O4 | Fe | FeCl2 | FeCl3 |
C | H2SO4 | SO2 | S | SO3 |
D | N2 | NH3 | NO | NO2 |
A. AB. BC. CD. D