题目内容
【题目】基于新材料及3D打印技术,科学家研制出一种微胶囊吸收剂能将工厂排放的CO2以更加安全、廉价和高效的方式处理掉,球形微胶囊内部充入Na2CO3溶液,其原理如图所示。
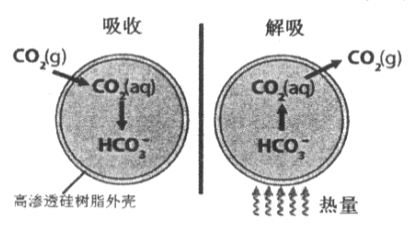
(1)这种微胶囊吸收CO2的原理是________(用离子方程式解释),此过程是____(填“吸收”或“放出”)能量的过程。
(2)在吸收过程中关于胶囊内溶液下列说法正确的是_____________。
a. 吸收前溶液中c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
b. 吸收过程中,体系中的含碳微粒只有CO32-、HCO3-、H2CO3
c. 当n(CO2):n(Na2CO3)=1:3时,溶液中c(CO32-)<c(HCO3-)
d. 溶液中始终有c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
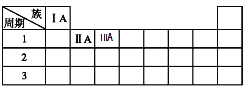
(3)下表为元素周期表的一部分,请将Na、C元素填在表中对应的位置上______________。
(4)生活中,经常用热的碳酸钠溶液清洗油污,结合化学用语,用必要的文字说明原因______________________。
(5)太阳能热电化学(STEP)生产水泥法可使二氧化碳排放量完全为零。基本原理如下图所示。利用熔融的碳酸钠为电解质,碳酸钙先分解成为CaO和CO2。最后得到石灰(CaO)、碳和氧气。
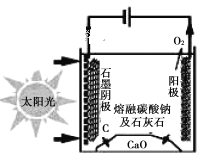
石墨电极上的电极反应式是_________。
【答案】CO2+H2O+CO32-=2HCO3- 放出 cd 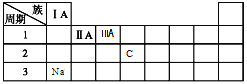 CO32— +H2O
CO32— +H2O![]() HCO3—+OH—,水解吸热,加热可使平衡正移,c(OH—)增大,碱性增强,油脂更易水解 3CO2+4e-═C+2CO32-
HCO3—+OH—,水解吸热,加热可使平衡正移,c(OH—)增大,碱性增强,油脂更易水解 3CO2+4e-═C+2CO32-
【解析】
(1)根据CO2与碳酸钠溶液反应分析;
(2)根据盐类水解反应原理结合物料守恒和电荷守恒关系判断;
(3)根据Na、C元素的原子结构分析在元素周期表中的位置;
(4)加热促进碳酸钠溶液的水解,碱性增强,去污能力增强;
(5)该电解池中石墨阴极发生还原反应,据此解答。
(1) CO2被碳酸钠溶液吸收发生的反应为Na2CO3+CO2+H2O=2NaHCO3,离子方程式为CO2+H2O+CO32-=2HCO3-;由图可知,解吸过程为吸热过程,则吸收CO2过程为放出能量过程,
因此,本题正确答案为:CO2+H2O+CO32-=2HCO3-;放出;
(2) a. 吸收前溶液为Na2CO3溶液,由于水解CO32-+H2O![]() HCO3-+OH-,溶液呈碱性,离子浓度大小顺序为c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),故a错误;
HCO3-+OH-,溶液呈碱性,离子浓度大小顺序为c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),故a错误;
b. 吸收过程中生成NaHCO3,体系中的含碳微粒有CO32-、HCO3-、H2CO3以及溶解的CO2分子,故b错误;
c. 当n(CO2):n(Na2CO3)=1:3时,由反应式CO2+H2O+CO32-=2HCO3-可知,吸收1mol CO2要消耗1mol CO32-,同时生成2mol HCO3-,剩余2mol CO32-,溶液中生成的HCO3-与未反应的CO32-物质的量相等,但由于CO32-水解程度大于HCO3-,故c(CO32-)<c(HCO3-),故c正确;
d. 根据电荷守恒,溶液中始终有c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故d正确;
因此,本题正确答案为:cd;
(3)Na元素位于元素周期表第3周期第IA族,C元素位于元素周期表第2周期第IVA族,
因此,本题正确答案为: ;
;
(4) 生活中经常用热的碳酸钠溶液清洗油污,原因是碳酸钠在溶液中水解,使溶液呈碱性,水解反应是吸热反应,加热促进水解平衡正向移动,溶液中c(OH-)增大,碱性强,油脂更易水解。
因此,本题正确答案为:CO32— +H2O![]() HCO3—+OH—,水解吸热,加热可使平衡正移,c(OH—)增大,碱性增强,油脂更易水解;
HCO3—+OH—,水解吸热,加热可使平衡正移,c(OH—)增大,碱性增强,油脂更易水解;
(5) 由示意图可知,阳极上CO32—放电生成氧气,石墨阴极上二氧化碳得到电子生成C单质和碳酸根离子,电极反应式是3CO2+4e—===C+2CO32—。
因此,本题正确答案为:3CO2+4e—===C+2CO32—。

【题目】下列根据实验操作和实验现象所得出的结论不正确的是
选项 | 实验操作 | 实验现象 | 结论 |
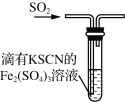
A | 将FeCl2样品溶于盐酸后,滴加KSCN溶液 | 溶液变成红色 | 原FeCl2样品已变质 |
B | 将Na2SO3样品溶于水,滴加入稀盐酸酸化的Ba(NO3)2溶液 | 产生白色沉淀 | 原Na2SO3样品已变质 |
C | 向淀粉KI溶液中滴入3滴稀硫酸,再加入10%的H2O2溶液 | 滴入稀硫酸未见溶液变蓝;加入H2O2溶液后,溶液立即变蓝 | 酸性条件下,H2O2氧化性强于I2 |
D | 向5mL0.5mol/LNaHCO3溶液中滴入2mL1mol/LBaCl2溶液 | 产生白色沉淀,且有无色气体生成 | 反应的化学方程式为NaHCO3 + BaCl2 BaCO3↓+ NaCl+ CO2↑+H2O |
A. A B. B C. C D. D