题目内容
11.在一密闭容器中,反应aA(g)?bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时B的浓度是原来的35%,则( )| A. | 物质A的转化率大了 | B. | a<b | ||
| C. | 物质B的质量分数减小了 | D. | 平衡向正反应方向移动了 |
分析 采用假设法分析,假设a=b,保持温度不变,将容器体积增加一倍,平衡不移动,A和B的浓度应均是原来的$\frac{1}{2}$倍,与达到新的平衡时B的浓度相比判断平衡移动,再根据平衡移动逐项判断.
解答 解:A、平衡时B的浓度是原来的35%,小于原来的$\frac{1}{2}$倍,说明平衡向逆反应反应方向移动,反应物转化率降低,故A错误;
B、增大体积,压强减小,平衡向逆反应方向移动,则说明a>b,故B错误;
C、平衡应向逆反应方向移动,物质B的质量减小,混合物总质量不变,所以物质B质量分数减小,故C正确;
D、平衡时B的浓度是原来的35%,小于原来的$\frac{1}{2}$倍,说明平衡向逆反应反应方向移动,故D错误;
故选C.
点评 本题考查化学平衡移动问题,题目难度不大,注意通过改变体积浓度的变化判断平衡移动的方向,此为解答该题的关键.

练习册系列答案
相关题目
14.下列说法正确的是( )
| A. | H、D、T表示三种氢原子 | |
| B. | 卤族元素最高化合价均为正7价,最低化合价均为负1价 | |
| C. | 金属元素的原子最外层电子数,都少于4个 | |
| D. | 目前人们已发现了5000多种核素,说明发现了5000多种元素 |
2.下列各组物质中属于同分异构体的是( )
| A. | 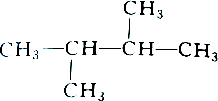 和 和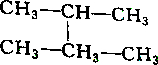 | B. | 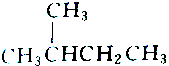 和 和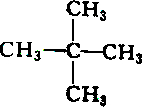 | ||
| C. | 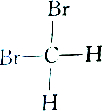 和 和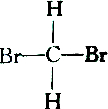 | D. | 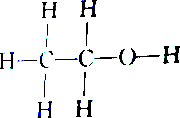 和 和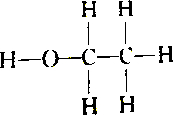 |
19.下列各组物质不互为等电子体的是( )
| A. | CO和N2 | B. | CO2和N2O | C. | CO32-和NO3- | D. | CO2和SO2 |
16.概括中学化学有关知识,有气味的气体一般( )
| A. | 密度比空气大 | B. | 能溶于水 | ||
| C. | 有一定颜色 | D. | 沸点比其他气体低 |
3.将H2S和SO2气体分别通入下列溶液中,只有一种气体反应是( )
| A. | 溴水 | B. | 酸性KMnO4 | C. | 浓HNO3 | D. | CuSO4溶液 |
20.一定量的锌片与过量2mol•L-1的盐酸跟反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是( )
| A. | 通入一定量的HCl气体 | B. | 加入数滴氯化铜溶液 | ||
| C. | 加入一定量6mol•L-1的硝酸溶液 | D. | 加入适量的CH3COONa固体 |
1.下列各组物质中化学键的类型相同的是( )
| A. | CaCl2 MgCl2 Na2O | B. | H2O Na2O ? CO2 | ||
| C. | CaCl2 ? NaOH H2SO4 | D. | NH4Cl H2O CO2 |
 .
.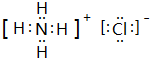 ,A2C2的电子式为
,A2C2的电子式为 .
.