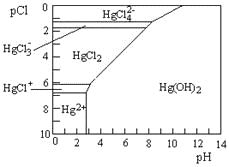
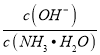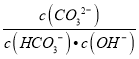题目内容
【题目】关于下列四个图像的说法中正确的是
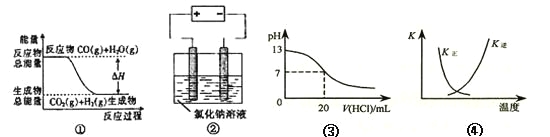
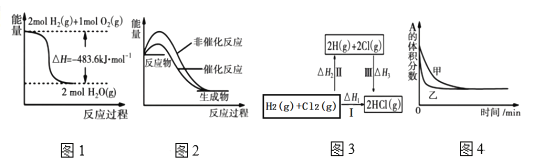
A.图①表示可逆反应“CO(g)+H2O(g)![]() CO2(g)+H2(g)”中的△H大于0
CO2(g)+H2(g)”中的△H大于0
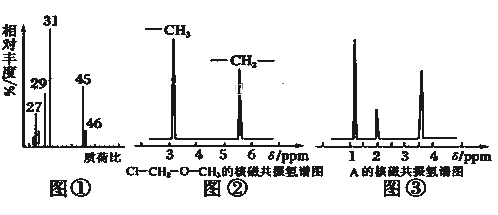
B.图②是在以石墨为电极电解氯化钠稀溶液的电解池中,阴、阳极产生气体体积之比一定为1:1
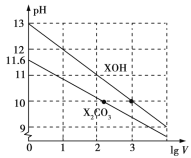
C.图③表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1NaOH溶液,溶液的pH随加入酸体积的变化
D.图④中曲线表示反应2SO2(g) + O2(g)![]() 2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
【答案】D
【解析】
A.图①中反应物的总能量大于生成物的总能量,则可逆反应CO(g)+H2O(g)![]() CO2(g)+H2(g)为放热反应,△H小于0,A错误;
CO2(g)+H2(g)为放热反应,△H小于0,A错误;
B.图②是以石墨为电极电解氯化钠稀溶液,开始发生反应2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,当NaCl完全反应后继续电解的方程式为2H2O
2NaOH+H2↑+Cl2↑,当NaCl完全反应后继续电解的方程式为2H2O![]() 2H2↑+O2↑,则阴、阳两极产生气体体积之比不一定为1:1,B错误;
2H2↑+O2↑,则阴、阳两极产生气体体积之比不一定为1:1,B错误;
C.25℃,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1NaOH溶液,当加入的盐酸的体积在20mL附近时应发生pH的突变,C错误;
D.升高温度平衡逆向移动,则升高温度,K正减小、K逆增大,D正确;
答案选D。

练习册系列答案
相关题目