题目内容
【题目】常温下,下列说法不正确的是
A.等体积、等物质的量浓度的NaCl(aq) 离子总数大于NaClO(aq)中离子总数
B.pH=3的硫酸溶液中水的电离程度等于pH=11的氨水溶液中水的电离程度
C.0.1 mol/L的NaHA溶液pH=5,则溶液:c(HA-)>c(H+)>c(A2-)>c(H2A)
D.向NH4HSO4溶液中滴加NaOH溶液至中性,所得混合液:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+)
【答案】D
【解析】
A. HClO是弱酸,所以NaClO溶液中发生水解反应:ClO-+H2O![]() HClO+OH-,使溶液呈碱性,氢离子浓度小于10-7mol/L,所以NaCl溶液中c(Na+)+c(H+)大于NaClO溶液中c(Na+)+c(H+),根据电荷守恒:c(Na+)+c(H+)=C(OH-)+c(Cl-),可得溶液中离子总数为2×[c(Na+)+c(H+)]×V;同理可得NaClO溶液中总数为2×[c(Na+)+c(H+)]×V,所以NaCl溶液中离子总数大于NaClO溶液,A项正确;
HClO+OH-,使溶液呈碱性,氢离子浓度小于10-7mol/L,所以NaCl溶液中c(Na+)+c(H+)大于NaClO溶液中c(Na+)+c(H+),根据电荷守恒:c(Na+)+c(H+)=C(OH-)+c(Cl-),可得溶液中离子总数为2×[c(Na+)+c(H+)]×V;同理可得NaClO溶液中总数为2×[c(Na+)+c(H+)]×V,所以NaCl溶液中离子总数大于NaClO溶液,A项正确;
B.同浓度的H+和OH-对水电离的抑制程度相同,pH=3的硫酸溶液和pH=11的氨水溶液中氢离子浓度和OH-浓度相同,水的电离程度相同,B项正确;
C. 0.1 mol/L的NaHA溶液pH=5,说明HA-离子的电离程度大于其水解程度,则溶液:c(HA-)>c(H+)>c(A2-)>c(H2A),C项正确;
D. 向NH4HSO4溶液中滴加NaOH溶液至中性,OH-先和H+反应,当物质的量为1:1时,不考虑其它变化,Na+、NH4+、SO42-物质的量相等,实际上NH4+水解导致溶液显酸性,需再滴加NaOH,当溶液呈中性时,c(Na+)>c(SO42-)>c(NH4+) >c(OH-)=c(H+),D项错误;
答案选D。

 阅读快车系列答案
阅读快车系列答案【题目】在2 L密闭容器中,800℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应________(填“是”或“不是”)可逆反应。
(2)如图所示,表示NO2变化曲线的是______。用O2表示从0~2s内该反应的平均速率v=________。
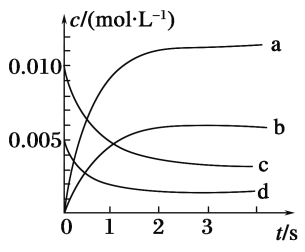
(3)能说明该反应已达到平衡状态的是________(填序号)。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
【题目】为有效控制雾霾,各地积极采取措施改善大气质量。其中,控制空气中氮氧化物和硫氧化物的含量尤为重要。
(1)煤燃烧产生的烟气中含有氮的氧化物,用CH4催化还原NO2可消除氮氧化物的污染。已知:
①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H= -867.0kJ/mol;
②N2(g)+2O2(g)=2NO2(g) △H=+67.8kJ/mol;
③N2(g)+O2(g)=2NO(g) △H=+89.0kJ/mol
则CH4催化还原NO的热化学方程式为_______。
(2)将0.20mol NO和0.10mol CO充入一个温度恒定、容积恒为2L的密闭容器中发生反应2NO(g)+2CO(g)=N2(g)+2CO2(g),可实现氮氧化物的转化,反应过程中部分物质的物质的量变化如图所示。
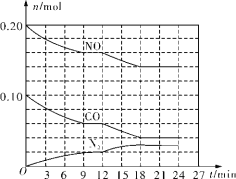
①N2在0~9min内的平均反应速率v(N2)=________mol/(L·min)(保留两位有效数字)。
②第12min时改变的反应条件可能为________(填字母代号)。
a.充入水蒸气稀释反应物 b.加入NO c.加催化剂 d.增大压强
(3)室温下,烟气中的SO2可用某浓度的NaOH溶液吸收得到pH=7的溶液,试计算所得溶液中![]() =_____(已知:常温下H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)。
=_____(已知:常温下H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)。
(4)烟气中的SO2也可用Na2SO3溶液吸收,吸收过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 99:1 | 1:1 | 1:99 |
pH | 8.2 | 7.2 | 6.2 |
当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母): ___________
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+) =c(SO32-)+c(HSO3-)+c(OH-)