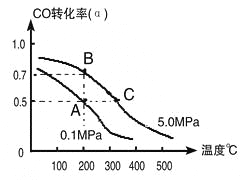
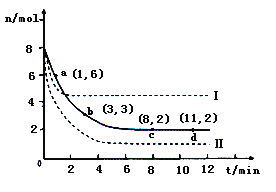
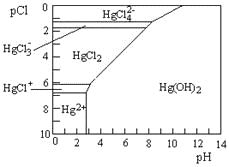
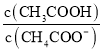题目内容
【题目】关于 所具有性质说法不正确的是
所具有性质说法不正确的是
A.该有机物加入FeCl3溶液,显紫色
B.通常条件下,1mol该有机物与饱和溴水反应最多消耗2molBr2
C.通常条件下,1mol该有机物最多可与1molNaOH溶液反应
D.1mol该有机物最多可与4molH2反应
【答案】B
【解析】
A. 有机物中含有酚羟基,加入FeCl3溶液,显紫色,A项正确;
B. 有机物中含有碳碳双键、酚羟基,酚羟基的两个邻位可被溴取代,则1mol该有机物与饱和溴水反应最多消耗3mol Br2,B项错误;
C. 1mol有机物中含有1mol酚羟基,酚羟基具有酸性,能和1mol氢氧化钠发生中和反应,C项正确;
D. 有机物中的苯环和双键可以与4mol H2加成,D项正确;
答案选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】下列实验结论与实验现象相符合的一组是
选项 | 实验 | 现象 | 结论 |
A | 向某盐溶液中加入浓NaOH溶液,加热 | 产生的气体能使湿润的红色石蕊试纸变蓝 | 原溶液中含有 |
B | 把SO2通入紫色的酸性高锰酸钾溶液中 | 溶液紫色褪去 | SO2具有漂白性 |
C | 向蔗糖中滴加浓硫酸 | 蔗糖变黑 | 浓硫酸具有吸水性 |
D | 向盛有Cu片的试管中加入稀H2SO4,无明显现象,再加入NaNO3固体 | Cu片逐渐溶解,产生气 泡,溶液变蓝 | NaNO3是催化剂,可增大Cu与稀H2SO4反应的化学反应速率 |
A.AB.BC.CD.D