题目内容
6.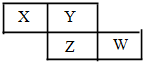 X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如下图所示.若Y原子的最外层电子是 k层电子数的3倍,下列说法不正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如下图所示.若Y原子的最外层电子是 k层电子数的3倍,下列说法不正确的是( )| A. | 氢化物的熔、沸点:H2Y>H2Z | |
| B. | 元素X、Z的最高价氧化物对应的水化物都是强酸 | |
| C. | W元素的阴离子与Ar原子具有相同的电子层结构 | |
| D. | X与Y形成的化合物都易溶于水 |
分析 X、Y、Z、W均为短周期元素,根据他们在周期表中的位置知,X和Y属于第二周期元素,Z和W属于第三周期元素,Y原子的最外层电子数是K层电子数的3倍,所以其最外层电子数是6,则Y是O元素,可推知X是N元素,Z是S元素,W是Cl元素,结合元素周期律与元素化合物性质来分析解答.
解答 解:X、Y、Z、W均为短周期元素,根据他们在周期表中的位置知,X和Y属于第二周期元素,Z和W属于第三周期元素,Y原子的最外层电子数是K层电子数的3倍,所以其最外层电子数是6,则Y是O元素,可推知X是N元素,Z是S元素,W是Cl元素.
A.水分子之间存在氢键,故氢化物的熔、沸点:H2O>H2S,故A正确;
B.元素X、Z的最高价氧化物对应的水化物分别为硝酸、硫酸,二者都是强酸,故B正确;
C.W元素的阴离子为Cl-,其核外电子数为18,与Ar原子具有相同的电子层结构,故C正确;
D.X与Y形成的化合物中,NO不溶于水,故D错误,
故选D.
点评 本题考查元素周期表、核外电子排布、元素周期律等,根据Y进行推断,注意氢键对物质性质的影响,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
16.下列反应中,属于吸热反应的是( )
| A. | 活泼金属跟酸反应 | B. | 煤气燃烧 | ||
| C. | 酸碱中和反应 | D. | 工业制生石灰 |
14.元素X的原子核外M电子层上有3个电子,元素Y2-的离子核外有18个电子,则这两种元素可形成的化合物为( )
| A. | XY2 | B. | X2Y3 | C. | X3Y2 | D. | X2Y |
1.类比推理是化学学习中的一种重要方法.下列类推结论正确的是( )
| 类比对象 | 结论 | |
| A | Cl2+H2O$\frac{\underline{\;\;△\;\;}}{\;}$HCl+HClO | I2+H2O$\frac{\underline{\;\;△\;\;}}{\;}$HI+HIO |
| B | C+2CuO$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+CO2↑ | C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑ |
| C | Na2O+H2O=2NaOH | CuO+H2O=Cu(OH)2 |
| D | Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO | Ca(ClO)2+SO2+H2O=CaSO3↓+2HClO |
| A. | A | B. | B | C. | C | D. | D |
11.下表是不同温度下水的离子积的数据:
试回答以下问题:
(1)若25<t1<t2,则a>1×10-14(填“>”、“<”或“=”),做此判断的理由是温度升高,水的电离程度增大,离子积增大.
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol•L-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=1 000:1.
(3)在t2温度下测得某溶液pH=7,该溶液显碱(填“酸”、“碱”或“中”)性,将此温度下pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合,若所得混合液pH=2,则a:b=9:11.
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积 | 1×10-14 | a | 1×10-12 |
(1)若25<t1<t2,则a>1×10-14(填“>”、“<”或“=”),做此判断的理由是温度升高,水的电离程度增大,离子积增大.
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol•L-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=1 000:1.
(3)在t2温度下测得某溶液pH=7,该溶液显碱(填“酸”、“碱”或“中”)性,将此温度下pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合,若所得混合液pH=2,则a:b=9:11.
18.向盐酸中加入浓硫酸时产生白雾,下列叙述不属于产生该现象的原因是( )
| A. | 浓硫酸具有脱水性 | B. | 浓硫酸具有吸水性 | ||
| C. | 盐酸具有挥发性 | D. | 气体的溶解度的随温度升高而降低 |

 .
. ,化合物Ⅳ通过消去反应生成化合物Ⅰ的化学方程式为
,化合物Ⅳ通过消去反应生成化合物Ⅰ的化学方程式为 .
.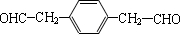 (写一种即可).
(写一种即可). 单体的结构简式为
单体的结构简式为 ;利用题中所给信息,自选合适的原料通过一步反应合成该单体,写出其化学方程式
;利用题中所给信息,自选合适的原料通过一步反应合成该单体,写出其化学方程式 .
.