题目内容
14.元素X的原子核外M电子层上有3个电子,元素Y2-的离子核外有18个电子,则这两种元素可形成的化合物为( )| A. | XY2 | B. | X2Y3 | C. | X3Y2 | D. | X2Y |
分析 元素X的原子核外M电子层有3个电子,则X为Al元素,元素Y2-离子核外共有18个电子,则Y为S元素,二者化合时,Al元素为+3价、S元素表现-2价,据此书写化学式判断.
解答 解:元素X的原子核外M电子层有3个电子,则X为Al元素;元素Y2-离子核外共有18个电子,则Y为S元素,Al、S元素最外层电子数分别是3、6,Al元素正化合价为+3价、S元素负化合价为-2价,二者化合时生成物的化学式为Al2S3,故X2Y3符合,故选B.
点评 本题考查原子结构和元素性质,熟悉主族元素化合价与最外层电子数的关系,题目难度不大.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
4.研究表明生命起源于火山爆发,是因为火山爆发产生的气体中含有1%的羰基硫(COS),已知羰基硫分子中所有原子均满足八电子结构,结合周期表知识,有关说法不正确的是( )
| A. | 羰基硫分子为非极性分子 | |
| B. | 羰基硫的结构式为:O=C=S | |
| C. | 羰基硫沸点比CO2高 | |
| D. | 羰基硫分子中三个原子处于同一直线上 |
5.从柑桔中可炼制萜二烯(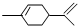 ),下列有关它的推测不正确的是( )
),下列有关它的推测不正确的是( )
 ),下列有关它的推测不正确的是( )
),下列有关它的推测不正确的是( )| A. | 分子中有10个C原子 | |
| B. | 与过量溴的CCl4 溶液反应后产物(右图)为: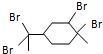 | |
| C. | 能发生加聚反应 | |
| D. | 常温下呈液态难溶于水 |
2.对于反应:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,已知158g KMnO4反应生成了16g O2,则固体残余物的质量是( )
| A. | 16g | B. | 32g | C. | 126g | D. | 142g |
9.下列说法错误的是( )
| A. | 含有离子键的化合物一定是离子化合物 | |
| B. | 共价化合物中一定没有离子键 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 双原子单质分子中的共价键一定是非极性键 |
6.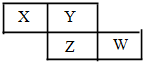 X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如下图所示.若Y原子的最外层电子是 k层电子数的3倍,下列说法不正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如下图所示.若Y原子的最外层电子是 k层电子数的3倍,下列说法不正确的是( )
 X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如下图所示.若Y原子的最外层电子是 k层电子数的3倍,下列说法不正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如下图所示.若Y原子的最外层电子是 k层电子数的3倍,下列说法不正确的是( )| A. | 氢化物的熔、沸点:H2Y>H2Z | |
| B. | 元素X、Z的最高价氧化物对应的水化物都是强酸 | |
| C. | W元素的阴离子与Ar原子具有相同的电子层结构 | |
| D. | X与Y形成的化合物都易溶于水 |
3.下列溶液可用无色试剂瓶装的是( )
| A. | HNO3 | B. | AgNO3 | C. | 氯水 | D. | H2SO4 |
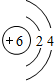 ,元素C在周期表中的位置为第三周期ⅣA族,E的元素名称为氯.
,元素C在周期表中的位置为第三周期ⅣA族,E的元素名称为氯.