题目内容
10.m g饱和一元醇在氧气中完全燃烧后生成14.4g水和13.44L标准状况下的CO2气体.(1)试确定该醇的分子式.
(2)m的值是多少?
分析 饱和一元醇的组成通式为CnH2n+2O,计算水、二氧化碳物质的量,结合C、H原子数目关系确定n的值,确定醇的分子式,根据碳原子守恒确定醇的物质的量,再根据m=nM计算醇的质量,结合该醇能发生催化氧化,产物含醛基,确定醇的可能结构.
解答 解:(1)水的物质的量为$\frac{14.4g}{18g/mol}$=0.8mol,二氧化碳物质的量为$\frac{13.44L}{22.4L/mol}$=0.6mol,
令饱和一元醇的组成通式为CnH2n+2O,则:
0.6mol:1.6mol=n:(2n+2)
解得n=3,
故该饱和一元醇分子式为C3H8O,
答:该醇的分子式为:C3H8O;
(2)由碳原子守恒,该醇的物质的量为$\frac{0.6mol}{3}$=0.2mol,质量为0.2mol×60g/mol=12g,即m=12,
答:m的值为12.
点评 本题考查有机物推断,属于计算型推断,注意利用饱和一元醇的组成通式解答,难度不大.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
20.化合物HIn在水溶液中存在以下电离平衡:
HIn(溶液)?H+(溶液)+In-(溶液)
红色 黄色
故可用于作酸碱指示剂,现有浓度均为0.02mol/L的下列溶液
①盐酸 ②石灰水 ③NaCl溶液 ④NaHSO4溶液⑤NaHCO3溶液 ⑥氨水
其中能使指示剂显红色的是( )
HIn(溶液)?H+(溶液)+In-(溶液)
红色 黄色
故可用于作酸碱指示剂,现有浓度均为0.02mol/L的下列溶液
①盐酸 ②石灰水 ③NaCl溶液 ④NaHSO4溶液⑤NaHCO3溶液 ⑥氨水
其中能使指示剂显红色的是( )
| A. | ①④ | B. | ①④⑤ | C. | ②⑥ | D. | ②⑤⑥ |
1.已知醇之间发生反应:R-OH+H-OR′$→_{△}^{浓硫酸}$R-O-R′(醚)+H2O,由两种不同的醇反应得到某醚M为C5H11OC5H11,它代表了多少种物质( )
| A. | 28 | B. | 36 | C. | 64 | D. | 48 |
2.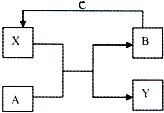 A、B、C、X和Y均为中学常见物质,其中A、B、C为单质,X、Y为化合物,它们在一定条件下可发生如右图所示反应,下列说法不正确的是( )
A、B、C、X和Y均为中学常见物质,其中A、B、C为单质,X、Y为化合物,它们在一定条件下可发生如右图所示反应,下列说法不正确的是( )
 A、B、C、X和Y均为中学常见物质,其中A、B、C为单质,X、Y为化合物,它们在一定条件下可发生如右图所示反应,下列说法不正确的是( )
A、B、C、X和Y均为中学常见物质,其中A、B、C为单质,X、Y为化合物,它们在一定条件下可发生如右图所示反应,下列说法不正确的是( )| A. | 若X是光导纤维的主要成分,工业上常利用反应I制备B,Y的化学式为CO | |
| B. | 若A、B为生活中常见的两种金属单质,X是一种黑色磁性物质.X与氢碘酸反应的离子方程式为Fe3O4+8H++2I-=3Fe 2++I2+4H2O | |
| C. | 若组成A的元素在短周期中原子半径最大(稀有气体除外),以Y为电解质溶液,气体B为燃料,C为氧化剂可构成燃料电池,工作一段时间后,Y溶液的pH增大 | |
| D. | 若常温下A、B、C和X均为气体,Y为固体,管道工人曾利用反应X检验氯气管道是否漏气,Y的电子式为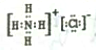 |
19.下列反应中前者属于取代反应,后者属于加成反应的是( )
| A. | 光照甲烷与氯气的混合物;乙烯使酸性高锰酸 钾溶液褪色 | |
| B. | 乙烯使溴的四氯化碳溶液褪色;苯与氢气在一定条件下反应生成环己烷 | |
| C. | 苯滴人浓硝酸和浓硫酸的混合液中水浴加热; 乙烯与水蒸气在一定条件下反应生成乙醇 | |
| D. | 在苯中滴人溴水,溴水褪色;乙烯使溴水褪色. |
17.H2和I2在一定条件下能发生反应:H2(g)+I2(g)═2HI(g)△H=-a kJ•mol-1已知: (a、b、c均大于零)下列说法不正确的是( )
(a、b、c均大于零)下列说法不正确的是( )
 (a、b、c均大于零)下列说法不正确的是( )
(a、b、c均大于零)下列说法不正确的是( )| A. | 反应物的总能量高于生成物的总能量 | |
| B. | 断开1 mol H-H键和1 mol I-I键所需能量大于断开2 mol H-I键所需能量 | |
| C. | 断开2 mol H-I键所需能量约为(c+b+a) kJ | |
| D. | 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ |