题目内容
5.普通干电池两极材料是锌和石墨棒,两极间为MnO2、NH4Cl、ZnCl2糊状物,下列说法错误的是( )| A. | 干电池中锌作负极,石墨棒作正极 | |
| B. | 负极发生还原反应:Zn-2e-═Zn2+ | |
| C. | MnO2的作用是把正极附近生成的氢气氧化成水,避免氢气泡出现 | |
| D. | 干电池工作时,由化学能转变为电能 |
分析 原电池是化学能转化为电能的装置,日常所用干电池的电极分别为碳棒和锌皮,以糊状NH4Cl和ZnCl2作电解质,其中加入MnO2氧化吸收H2,电极反应可简化为:Zn-2e-=Zn2+;2NH4++2e-=2NH3+H2,NH3再用于结合Zn2+,据此分析.
解答 解:A、锌是活泼金属作负极,石墨棒作正极,故A正确;
B、负极发生氧化反应,电极反应式为:Zn-2e-═Zn2+,故B错误;
C、加入MnO2氧化吸收H2,故C正确;
D、原电池是化学能转化为电能的装置,故D正确;
故选B.
点评 本题考查了干电池的工作原理,难度不大,明确干电池中正负极反应是关键.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
19.下列反应中前者属于取代反应,后者属于加成反应的是( )
| A. | 光照甲烷与氯气的混合物;乙烯使酸性高锰酸 钾溶液褪色 | |
| B. | 乙烯使溴的四氯化碳溶液褪色;苯与氢气在一定条件下反应生成环己烷 | |
| C. | 苯滴人浓硝酸和浓硫酸的混合液中水浴加热; 乙烯与水蒸气在一定条件下反应生成乙醇 | |
| D. | 在苯中滴人溴水,溴水褪色;乙烯使溴水褪色. |
13.下列各组离子在指定环境中一定能大量共存的是( )
| A. | 使pH试纸显深蓝色的溶液中,Cu2+、NO3-、Fe3+、SO42- | |
| B. | 在使红色石蕊试纸变蓝的溶液中:SO32-、CO32-、Na+、K+ | |
| C. | pH=0的溶液中:Al3+、NH4+、Ca2+、ClO- | |
| D. | 与铝粉反应放出氢气的无色溶液中:NO3-、Mg2+、Na+、SO42- |
17.H2和I2在一定条件下能发生反应:H2(g)+I2(g)═2HI(g)△H=-a kJ•mol-1已知: (a、b、c均大于零)下列说法不正确的是( )
(a、b、c均大于零)下列说法不正确的是( )
 (a、b、c均大于零)下列说法不正确的是( )
(a、b、c均大于零)下列说法不正确的是( )| A. | 反应物的总能量高于生成物的总能量 | |
| B. | 断开1 mol H-H键和1 mol I-I键所需能量大于断开2 mol H-I键所需能量 | |
| C. | 断开2 mol H-I键所需能量约为(c+b+a) kJ | |
| D. | 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ |
14.在实验室里用铁屑、氧化铜、稀硫酸为原料制备铜,有下列两种途径:若用这两种方法制得的铜质量相等,则下列有关说法符合实际情况的是( )
(1)Fe$\stackrel{H_{2}SO_{4}}{→}$H2$\stackrel{CuO}{→}$Cu
(2)CuO$\stackrel{H_{2}SO_{4}}{→}$CuSO4$\stackrel{Fe}{→}$Cu.
(1)Fe$\stackrel{H_{2}SO_{4}}{→}$H2$\stackrel{CuO}{→}$Cu
(2)CuO$\stackrel{H_{2}SO_{4}}{→}$CuSO4$\stackrel{Fe}{→}$Cu.
| A. | 消耗氧化铜的质量不同 | B. | 消耗铁的质量相同 | ||
| C. | 消耗硫酸的质量相同 | D. | 生成硫酸亚铁的质量不同 |
15.设NA为阿伏伽德罗常数,下列说法中正确的是( )
| A. | 含有1mol Na2SO4的溶液中,含有的Na+个数为NA | |
| B. | 18g水中含有电子数为8NA | |
| C. | 标准状况下,22.4LH2含有氢原子个数为2NA | |
| D. | 1.2L H2一定含有NA个氢原子 |

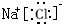 ,用电子式表示水的形成过程
,用电子式表示水的形成过程