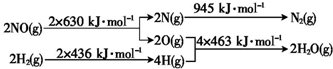
题目内容
13.设NA为阿伏伽德罗常数的值,下列说法正确的是( )| A. | 在标准状况下,2.24 L苯含有的分子数为0.1NA | |
| B. | 100ml 1mol/L的NH4Cl溶液中,NH4+的数目为0.1NA | |
| C. | 7.8 g Na2S和Na2O2的混合物中所含离子数为0.3NA | |
| D. | 电解精炼铜时,阳极质量每减少32 g,电路中就转移NA个电子 |
分析 A、标准状况下气体摩尔体积为22.4L/mol,苯不是气体;
B、铵根离子属于弱碱阳离子水溶液中水解减少;
C、Na2S和Na2O2的摩尔质量相同,依据n=mM计算物质的量,结合硫化钠是钠离子和硫离子构成,过氧化钠是钠离子和过氧根离子构成分析;
D、电解精炼铜阳极是粗铜,含有铁、锌、镍、金银等杂质,其中铁、锌、镍都可以失电子发生氧化反应;
解答 解:A、标准状况下苯不是气体,2.24 L苯不是0.1mol,故A错误;
B、铵根离子属于弱碱阳离子,水溶液中水解减少,100ml 1mol/L的NH4Cl溶液中,NH4+的数目小于0.1NA,故B错误;
C、Na2S和Na2O2的摩尔质量都为78g/mol,物质的量n=mM=7.8g78g/mol=0.1mol,结合硫化钠是钠离子和硫离子构成,过氧化钠是钠离子和过氧根离子构成分析,0.1molNa2S和Na2O2的混合物中所含离子数为0.3NA,故C正确;
D、电解精炼铜阳极是粗铜,含有铁、锌、镍、金银等杂质,其中铁、锌、镍都可以失电子发生氧化反应,阳极质量每减少32 g全部是铜单质转移为0.1NA,但粗铜做阳极不全是铜,电路中转移电子数不是NA个,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积条件的分析判断,电解原理、物质结构、盐类水解实质的分析应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
2.下列各组微粒在指定溶液中一定能大量共存的是( )
| A. | 石蕊变红色的溶液:Na+、Mg2+、Cl-、SO42- | |
| B. | 能溶解氧化铝粉末的溶液中:K+、N03-、Cl-、NH4+ | |
| C. | 滴加苯酚溶液显紫色的溶液:NH4+、K+、Cl-、H2S | |
| D. | 由水电离出的c(H+)=10-12mol.L-1的溶液:Na+、K+、NO3-、C6H5O- |
1.(1)某同学欲配制98.0mL0.10mol•L-1的CuSO4溶液.以下操作1~5是其配制的过程及示意图:
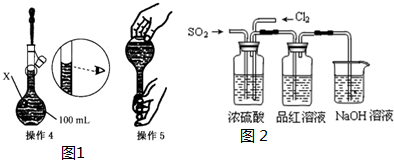
①仪器X的名称是100mL容量瓶.
②关于该配制过程,下列说法正确的是AB.
A.操作1中,应称取胆矾晶体的质量为2.5g
B.操作2中,洗涤液需要转移到仪器X中
C.操作4称为定容,由于该同学观察方法不正确,将导致所配溶液浓度偏高
D.操作5摇匀后静置,发现液面低于刻度线,应继续加水至凹液面与刻度线相切
(2)甲、乙同学用下图装置验证SO2和Cl2的漂白性:甲同学按1:1通气时,品红溶液几乎不褪色,品红溶液不褪色的原因是(用方程式表示):SO2+Cl2+2H2O=SO42-+2Cl-+4H+;而乙同学的实验现象是品红溶液随时间的推移变得越来越浅,乙同学做到让品红溶液变得越来越浅的原因是增加二氧化硫的通入量或增加氯气通入量.
| 操作1:准确称取一定质量的胆矾晶体并用适量蒸馏水溶解. 操作2:将所得溶液转移到仪器X中,用蒸馏水冲洗烧杯和玻璃棒2~3次,将洗涤液也转移到X中. 操作3:继续向X中加蒸馏水至液面 离X的刻度线l~2cm处. |

①仪器X的名称是100mL容量瓶.
②关于该配制过程,下列说法正确的是AB.
A.操作1中,应称取胆矾晶体的质量为2.5g
B.操作2中,洗涤液需要转移到仪器X中
C.操作4称为定容,由于该同学观察方法不正确,将导致所配溶液浓度偏高
D.操作5摇匀后静置,发现液面低于刻度线,应继续加水至凹液面与刻度线相切
(2)甲、乙同学用下图装置验证SO2和Cl2的漂白性:甲同学按1:1通气时,品红溶液几乎不褪色,品红溶液不褪色的原因是(用方程式表示):SO2+Cl2+2H2O=SO42-+2Cl-+4H+;而乙同学的实验现象是品红溶液随时间的推移变得越来越浅,乙同学做到让品红溶液变得越来越浅的原因是增加二氧化硫的通入量或增加氯气通入量.
8.有短周期的aXn+、bYm- 两种元素的简单离子,若它们的电子层结构相同,则下列关系正确的是( )
| A. | b-a=n+m | B. | a-b=n+m | C. | 核电荷数X>Y | D. | 质子数Y>X |
5.除去溴乙烷中的溴单质,最恰当的试剂是( )
| A. | NaOH溶液 | B. | Na2CO3溶液 | C. | NaHSO3溶液 | D. | KI溶液 |
3.下列说法正确的是( )
| A. | 有H、D、T与16O、17O、18O构成的过氧化氢分子的相对分子质量有36个 | |
| B. | H2、D2、T2互为同素异形体 | |
| C. | H2、D2、T2在相同条件下的密度比为1:2:3 | |
| D. | 氕、氘发生核聚变成其他元素,属于化学变化 |

 氢是一种重要的非金属元素.氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用.
氢是一种重要的非金属元素.氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用.