题目内容
18.A、B、C、D四种元素在周期表中分别处于元素X的四周(如图),已知X元素最高价氧化物的化学式为X2O5,且五种元素中有一种元素的原子半径是它们所处的同族中最小的.试确定:| B | ||
| A | X | C |
| D |
(2)画出C元素的简单阴离子的结构示意图:
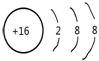
(3)C、D、X最高价氧化物对应水化物酸性由强到弱的顺序:C>X>D(用C、D、X表示).
(4)把A、B、X气态氢化物按照稳定性由强到弱的顺序排列:SiH4<PH3<NH3(用化学式表示).
附加题:A、B、C、D是原子序数小于20的四种元素,已知A元素+1价的阳离子与B、D的阴离子具有相同的电子层结构,B元素最高正价与负价的绝对值之差等于6.1mol C单质与足量的稀硫酸反应可生成1.5mol H2,反应后C元素原子形成的离子和氖原子的电子层结构相同.D元素原子的最外层电子数是C元素原子的最外层电子数的2倍.试回答:
(1)A、B、C、D四种元素依次是钾、氯、铝、硫(写出元素名称).
(2)写出A与C、B与D最高价氧化物的水化物的化学式(按酸性或碱性由强至弱的顺序)碱性:KOH>Al(OH)3,酸性:HClO4>H2SO4.
(3)写出A、C两元素最高价氧化物的水化物间反应的化学方程式Al(OH)3+OH-=AlO2-+2H2O.
分析 A、B、C、D四种元素在周期表中分别处于元素X的四周,X元素最高价氧化物的化学式为X2O5,X2O5中X的化合价为+5,则X是VA族元素.由于五种元素中有一种元素的原子半径是它们所处的同族中最小的,这种元素只能是B,则B为N元素,X为P,D为As,A为Si,C为S;
附加题:A、B、C、D是原子序数小于20的四种元素,B元素最高正价的绝对值与负价的绝对值之差等于6,则B为第ⅤⅡA族元素,所以B为氯元素,A元素+1价的阳离子与B、D的阴离子具有相同的电子层结构,则A为钾元素,1molC单质与足量的稀硫酸反应可生成1.5molH2,则C为第ⅢA族元素,反应后C元素原子形成的离子和氖原子的电子层结构相同,所以C为铝元素,D元素原子的最外层电子数是C元素原子的最外层电子数的2倍,且B、D的阴离子具有相同的电子层结构,则D为硫元素.
解答 解:A、B、C、D四种元素在周期表中分别处于元素X的四周,X元素最高价氧化物的化学式为X2O5,X2O5中X的化合价为+5,则X是VA族元素.由于五种元素中有一种元素的原子半径是它们所处的同族中最小的,这种元素只能是B,则B为N元素,X为P,D为As,A为Si,C为S.
(1)由上述分析可知,A为Si,B为N,C为S,X为P,故答案为:Si;N;S;P;
(2)C元素的简单阴离子为S2-,离子结构示意图: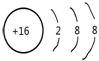 ,故答案为:
,故答案为: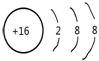 ;
;
(3)由于非金属性C>X>D,C、D、X最高价氧化物对应水化物酸性由强到弱的顺序:C>X>D,
故答案为:C>X>D;
(4)把A、B、X气态氢化物分别为SiH4、NH3、PH3,由于非金属性Si<P<N,稳定性由强到弱的顺序排列:SiH4<PH3<NH3,
故答案为:SiH4<PH3<NH3;
附加题:A、B、C、D是原子序数小于20的四种元素,B元素最高正价的绝对值与负价的绝对值之差等于6,则B为第ⅤⅡA族元素,所以B为氯元素,A元素+1价的阳离子与B、D的阴离子具有相同的电子层结构,则A为钾元素,1molC单质与足量的稀硫酸反应可生成1.5molH2,则C为第ⅢA族元素,反应后C元素原子形成的离子和氖原子的电子层结构相同,所以C为铝元素,D元素原子的最外层电子数是C元素原子的最外层电子数的2倍,且B、D的阴离子具有相同的电子层结构,则D为硫元素.
(1)由上面积分析可知,A、B、C、D四种元素依次是钾、氯、铝、硫,
故答案为:钾、氯、铝、硫;
(2)A、B、C、D四种元素最高价氧化物对应水化物的分别为KOH、HClO4、Al(OH)3、H2SO4,由金属性K>Al,故碱性:KOH>Al(OH)3,由于非金属性Cl>S,故酸性:HClO4>H2SO4,
故答案为:碱性:KOH>Al(OH)3,酸性:HClO4>H2SO4;
(3)A的最高价氧化物的水化物氢氧化钾,C两元素最高价氧化物的水化物为氢氧化铝,它们反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O.
点评 本题考查元素周期表及元素周期律、结构性质位置关系应用,难度不大,侧重对元素周期律的考查.

 阅读快车系列答案
阅读快车系列答案①CuS ②FeS ③SO3 ④Fe2O3 ⑤FeCl2⑥Hg2S.
| A. | ①②③⑤ | B. | ①③⑤⑥ | C. | ①③④⑤⑥ | D. | .全部 |
| A. | 离子化合物不可以含共价键 | |
| B. | 含有共价键的化合物不一定是共价化合物,但是共价化合物只能含有共价键 | |
| C. | 共价化合物可以含离子键 | |
| D. | 离子键、共价键、金属键和氢键都是化学键 |
| A. | HCO3-+H2O?H3O++CO32- | B. | NH4++H2O?NH3•H2O+H+ | ||
| C. | PO43-+H2O═HPO42-+OH- | D. | NH3+H2O?NH4++OH- |
| A. | 明矾中含SO42-,可与水中阳离子结合生成沉淀 | |
| B. | 因为明矾有强氧化性 | |
| C. | 明矾溶于水后,生成Al(OH)3胶体,起到净水作用 | |
| D. | 明矾含有两种金属阳离子K+、Al3+,吸附能力强 |
| A. | 液态溴有毒且易挥发,应贮存于磨口的细口瓶中,加水封,加盖橡胶塞,并放置于阴凉处 | |
| B. | 汽油或煤油存放在带橡胶塞的棕色玻璃瓶中 | |
| C. | 碳酸钠溶液或氢氧化钙溶液存放在配有磨口塞的棕色玻璃瓶中 | |
| D. | 氯水或硝酸银溶液存放在配有磨口塞的棕色玻璃瓶中 |
| A. | 氯化铝与氨水反应:Al3++3OH-═Al(OH)3↓ | |
| B. | 铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氯气与水反应:Cl2+H2O?2H++Cl-+ClO- | |
| D. | 向苏打溶液中加入足量的醋酸:CO32-+2CH3COOH═CO2↑+H2O+2CH3COO- |
 命名为“2乙基丙烷”,错误原因是主链选错;将其命名为“3甲基丁烷”,错误原因是编号错误.正确的命名为2-甲基丁烷.
命名为“2乙基丙烷”,错误原因是主链选错;将其命名为“3甲基丁烷”,错误原因是编号错误.正确的命名为2-甲基丁烷.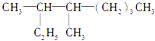 的名称是3,4-二甲基辛烷.
的名称是3,4-二甲基辛烷.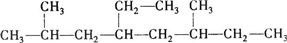 ,1mol该烷烃完全燃烧需消耗氧气18.5mol.
,1mol该烷烃完全燃烧需消耗氧气18.5mol.