题目内容
10.下列各项括号里的物质或操作是除去杂质所用的药品或方法,其中错误的是( )| A. | CaO中混有CaCO3(高温煅烧) | B. | CO混有CO2(石灰水) | ||
| C. | H2中混有HCl(NaOH溶液) | D. | Ca(OH)2中混有CaCO3(盐酸) |
分析 A.碳酸钙高温分解生成CaO;
B.二氧化碳与石灰水反应,而CO不能;
C.HCl与NaOH溶液反应,而氢气不能;
D.二者均与盐酸反应.
解答 解:A.碳酸钙高温分解生成CaO,则高温煅烧可除杂,故A正确;
B.二氧化碳与石灰水反应,而CO不能,则利用石灰水、洗气可除杂,故B正确;
C.HCl与NaOH溶液反应,而氢气不能,则利用NaOH溶液、洗气可除杂,故C正确;
D.二者均与盐酸反应,不能除杂,应利用过滤法除杂,故D错误;
故选D.
点评 本题考查混合物的分离提纯,为高频考点,把握物质的性质、发生的反应及混合物分离方法选择等为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
1.如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )


| A. | 该试剂的物质的量浓度为9.2mol•L-1 | |
| B. | 该硫酸50mL与足量的铜反应可得到标准状况下SO2 10.3L | |
| C. | 配制50mL 4.6mol•L-1的稀硫酸需取该硫酸12.5mL | |
| D. | 该硫酸与等体积的水混合所得溶液的质量分数小于49% |
18.下列各组中的元素,属于同一周期的是( )
| A. | Mg、Al、P | B. | O、Na、S | C. | N、O、Cl | D. | H、Li、Na |
5.下列叙述不正确的是( )
| A. | 切开的金属Na暴露在空气中,光亮的表面逐渐变暗,发生的反应为2Na+O2═Na2O2 | |
| B. | 4.6gNa与O2完全反应,生成7g产物时失去电子的物质的量为0.2 mol | |
| C. | Na与稀硫酸反应的离子方程式为2Na+2H+═2Na++H2↑ | |
| D. | 将少量Na投入到CuSO4溶液中,既有沉淀生成又有气体放出 |
15.pH值相等的盐酸(甲)和醋酸(乙),分别与锌反应,若最后锌已全部溶解且放出气体一样多,为此下列说法正确的是( )
| A. | 反应开始时的速率:甲>乙 | |
| B. | 反应结束时,pH值:甲=乙 | |
| C. | 反应开始时,酸的物质的量浓度:甲=乙 | |
| D. | 反应所需时间:甲>乙 |
17.下列说法正确的是( )
| A. | 氧化还原反应一定有氧元素参加 | |
| B. | 氧化还原反应的本质是电子的转移 | |
| C. | 物质中某元素失去电子,则此物质是氧化剂 | |
| D. | 某一反应中有元素化合价的变化,则该反应不一定是氧化还原反应 |
18.水及水溶液对生命活动必不可少,下列有关说法正确的是( )
| A. | 向水中加入明矾可以起到净水作用 | |
| B. | 热糖水降低温度后有固体析出,则原热糖水一定是饱和溶液 | |
| C. | 配制溶液时搅拌可以增大溶质的溶解度 | |
| D. | 物质溶于水时不会放出热量 |
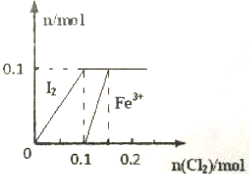 某实验小组向100mL FeI2溶液中逐渐通入Cl2,会依次发生如下反应:
某实验小组向100mL FeI2溶液中逐渐通入Cl2,会依次发生如下反应: