题目内容
14.下列条件下的反应,放出H2最快的是( )| 金属(粉末状)/mol | 酸的浓度和体积(mL) | 反应温度 | |||
| A | Mg | 0.1 | 3mol/L HCl | 10 | 20℃ |
| B | Al | 0.1 | 3mol/L HCl | 10 | 20℃ |
| C | Mg | 0.1 | 3mol/L CH3COOH | 10 | 20℃ |
| D | Mg | 0.1 | 3mol/L HNO3 | 10 | 30℃ |
| A. | A | B. | B | C. | C | D. | D |
分析 根据决定化学速率的因素是反应物本身的性质,影响化学反应速率的因素有浓度、温度、压强、催化剂、固体表面积等,硝酸与金属反应得不到氢气.
解答 解:因决定化学速率的因素是反应物本身的性质,在上述金属中镁的活泼性比铝强,金属与酸反应的本质是与氢离子反应,3mol/LHCl中氢离子的浓度为3mol/L,3mol/LCH3COOH中氢离子的浓度为远小于3mol/L,3mol/LHNO3中氢离子的浓度为3mol/L,但硝酸与金属反应得不到氢气,故选:A.
点评 抓住了决定因素就可解决问题,强调的是硝酸与金属反应得不到氢气.

练习册系列答案
相关题目
4.6种相邻短周期主族元素的相对位置如下表,M元素原子核外电子数是Y元素原子核外电子数的2倍,W元素原子的次外层电子数是最外层电子数的2倍.下列有关说法不正确的是( )
| X | Y | Z | |
| W | M | Q |
| A. | W的最高价氧化物可以和Z的氢化物反应 | |
| B. | X、Y、Z三种元素的原子半径由大到小的顺序为Z>Y>X | |
| C. | X的含10个电子的气态氢化物可以与X的最高价氧化物对应的水化物溶液反应生成盐 | |
| D. | 工业上电解Q元素的钠盐溶液可获得一种含Q元素的消毒剂 |
5.下列事实中能证明某化合物中一定是离子化合物的是( )
| A. | 可溶于水 | B. | 含有金属元素 | C. | 水溶液可导电 | D. | 熔融状态能导电 |
2.固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外层结构,则下列有关说法中不正确的是( )
| A. | 1 mol NH5中含有5NA个N-H键(NA表示阿伏加德罗常数) | |
| B. | NH5中既有共价键又有离子键,是离子化合物 | |
| C. | NH5的熔沸点高于NH3 | |
| D. | NH5固体投入少量水中,可产生两种气体 |
9.下列递变规律正确的是( )
| A. | 原子半径:O<S<Na | |
| B. | 碱性强弱:LiOH>KOH>CsOH | |
| C. | 还原性:HCl>HBr>HI | |
| D. | 热稳定性:H2O<NH3<SiH4的依次增强 |
19.下列分子中,所有碳原子一定在同一平面上的是( )
| A. | CH3-CH2-CH2-CH3 | B. | CH3-CH═CH-CH2-CH3 | ||
| C. | 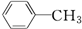 | D. | CH3-C≡C-CH3 |
6.已知:CH4+Br2$\stackrel{光}{→}$CH3Br+HBr;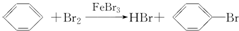
将甲苯与液溴混合,加入铁粉,其反应产物可能有( )
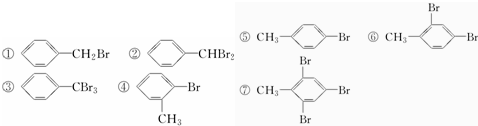
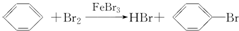
将甲苯与液溴混合,加入铁粉,其反应产物可能有( )

| A. | 只有①②③ | B. | 只有④⑤⑥⑦ | C. | 只有①⑤ | D. | ①②③④⑤⑥⑦ |
3.将X g聚苯乙烯树脂溶于Y L苯中,然后通入Z mol乙炔气体,所得混合液中C、H两元素的质量比为( )
| A. | 6:1 | B. | 12:1 | C. | 1:1 | D. | 1:2 |
4.下列混合物可用加热的方法分离的是( )
| A. | 碘和氯化铵 | B. | 硫酸钾和氯酸钾 | ||
| C. | 氯化铵和硫酸钡 | D. | 碳酸氢钠和碳酸氢铵 |