题目内容
【题目】可逆反应aA(g)+bB(s)cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是 ( )
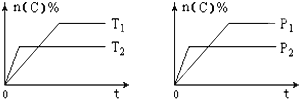
A. P1 > P2
B. 该反应的ΔH < 0
C. 化学方程式系数a>c+d
D. 使用催化剂,C的物质的量分数增加
【答案】B
【解析】A.先拐先平数值大,由右图可知,P2>P1,故A错误;B. 先拐先平数值大,由左图可知,T2>T1,升高温度C的物质的量分数减小,说明升高温度平衡逆向移动,则该反应为放热反应,ΔH < 0,故B正确;C. 由右图可知,P2>P1,增大压强C的物质的量分数减小,说明增大压强平衡逆向移动,则逆反应方向为气体体积减小的方向,所以化学方程式系数a<c+d,故C错误;D. 使用催化剂不能使化学平衡发生移动,则C的物质的量分数不变,故D错误;答案选B。
【题型】单选题
【结束】
22
【题目】25℃时,0.1 molL-1溶液的pH如下表,下列有关说法正确的是 ( )
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
pH | 7.0 | 7.0 | 8.1 | 8.4 |
A. 酸性强弱:HF<H2CO3
B. ①和②中溶质均未水解
C. 由水电离产生的c(H+):①>②
D. ④溶液中:c(HCO3-)+c(CO32-)+c(H2CO3)= c(Na+)
【答案】D
【解析】A. 根据盐水解时越弱越水解的规律,结合表中数据可知,F-的水解程度小于HCO3-的水解程度,所以酸性:HF>H2CO3,故A错误;B. ①中NaCl是强酸强碱盐,在水中不水解,②中CH3COONH4是弱酸弱碱盐,溶质会发生水解,只是CH3COO-和NH4+水解程度相同,使溶液呈中性,故B错误;C. 因NaCl是强酸强碱盐,在水中不发生水解,对水的电离无影响,而CH3COONH4是弱酸弱碱盐,溶质会发生水解,促进水的电离,故由水电离产生的c(H+):①<②,故C错误;D. 根据物料守恒可知,在NaHCO3溶液中,c(HCO3-)+c(CO32-)+c(H2CO3)= c(Na+),故D正确;答案选D。