题目内容
【题目】已知X为ⅠA族元素,Y为ⅦA族元素,则X与Y形成的化合物中相邻原子间存在的相互作用是
A.离子键B.极性共价键
C.非极性共价键D.范德华力
【答案】AB
【解析】
X为ⅠA族元素,包括H和碱金属元素,Y为ⅦA族元素,即卤族元素。若为X为H,则原子间形成极性共价键,若X为碱金属,则两者形成离子键。
综上所述,答案为AB。

【题目】【加试题】甲醇水蒸气重整制氢(SRM)是用于驱动电动汽车的质子交换膜燃料电池的理想氢源,当 前研究主要集中在提高催化剂活性和降低尾气中CO含量,以免使燃料电池Pt电极中毒。重整过程发生的反应如下:
反应I CH3OH(g)+H2O(g) ![]() CO2(g)+3H2(g) ΔH1
CO2(g)+3H2(g) ΔH1
反应Ⅱ CH3OH(g) ![]() CO(g)+2H2(g) ΔH2
CO(g)+2H2(g) ΔH2
反应Ⅲ.CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
其对应的平衡常数分别为K1、K2、K3,其中K2、K3随温度变化如下表所示:
125℃ | 225℃ | 325℃ | |
K2 | 0.5535 | 185.8 | 9939.5 |
K3 | 1577 | 137.5 | 28.14 |
请回答:
(1)反应Ⅱ能够自发进行的条件_______ (填 “低温”、“高温”或“任何温度”), ΔH1____ΔH3 (填 “>”、“<”或 “=” )。
(2)相同条件下,甲醇水蒸气重整制氢较甲醇直接分解制氢(反应Ⅱ)的先进之处在于_________。
(3)在常压、CaO催化下,CH3OH和H2O混和气体(体积比1∶1.2,总物质的量2.2mol)进行反应,tl时刻测得 CH3OH转化率及CO、CO2选择性随温度变化情况分别如图所示(CO、CO2的选择性:转化的CH3OH中生成CO、CO2的百分比)。
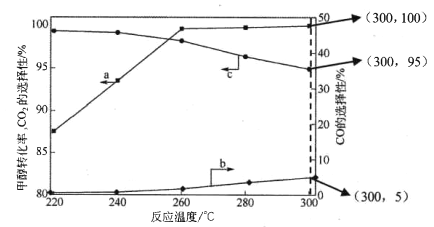
注:曲线a表示CH3OH的转化率,曲线b表示CO的选择性,曲线c表示 CO2的选择性
① 下列说法不正确的是_____。
A.反应适宜温度为300℃
B.工业生产通 常在负压条件下进行甲醇水蒸气重整
C.己知 CaO催化剂具有更高催化活性,可提高甲醇平衡转化率
D.添加CaO的复合催化剂可提高氢气产率
② 260℃ 时H2物质的量随时间的变化曲线如图所示。画出300℃时至t1时刻H2物质的量随时间的变化曲线_____。
(4)副产物CO2可以在酸性水溶液中电解生成甲酸,生成甲酸的电极反应式是_________。
【题目】硫代硫酸钠(Na2S2O3·5H2O)俗名“大苏打”,又称为“海波”。它易溶于水,难溶于乙醇,加热、遇酸均易分解。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图:
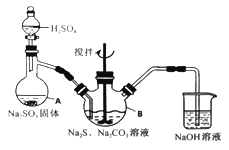
实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液的滴速,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸。
②直至析出的浑浊不再消失,并控制溶液的pH接近7时,停止通入SO2气体。
……
(1)写出仪器A的名称_______。
(2)为了保证硫代硫酸钠的产量,实验中不能让溶液pH <7,请用离子方程式解释原因_________。
(3)写出三颈烧瓶B中制取Na2S2O3,反应的总化学反应方程式________。
(4)从上述生成物混合液中获得较高产率Na2S2O3·5H2O的步骤为

为减少产品的损失,操作①为趁热过滤,“趁热”的原因是______;操作②是______;操作①是抽滤、洗涤、干燥。
(5)测定产品纯度
取6.00g产品,配制成100mL溶液。取10.00mL溶液,以淀粉溶液为指示剂,用浓度为0.500mol/LI2的标准溶液进行滴定,反应原理为2S2O32-+I2=S4O62-+2I-。相关数据记录如下表所示。
编号 | 1 | 2 | 3 |
溶液的体积/mL | 10.00 | 10.00 | 10.00 |
消耗I2标准溶液的体积/mL | 19.98 | 22.50 | 20.02 |
滴定时,达到滴定终点的现象是___________。产品的纯度为____________。
(6)Na2S2O3常用作脱氧剂,在溶液中易被Cl2氧化成SO42-,该反应的离子方程式为_________。