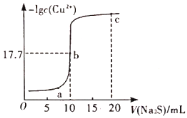
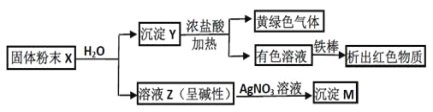
题目内容
【题目】反应原理在工业的应用:
(1)科研人员将粗锰(含杂质的锰)粉碎后加入到SnCl2溶液中使其溶解浸出(假定杂质不反应,溶液体积不变),发生反应Mn(s)+ Sn2+(aq)![]() Mn2+(aq)+ Sn(s),为加快反应速率可以采取的措施________;不考虑温度因素,一段时间后Mn的溶解速率加快,可能的原因是_______。
Mn2+(aq)+ Sn(s),为加快反应速率可以采取的措施________;不考虑温度因素,一段时间后Mn的溶解速率加快,可能的原因是_______。
(2)常温下,Ksp(FeS)=1×10-18,FeS饱和溶液中[H+]与[S2-]之间存在关系:[H+]2·[S2-]=1.0×10-22,为了使溶液里c(Fe2+) 达到1 mol·L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的PH=_______。
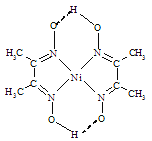
(3)工业上利用含镍废水(镍主要以NiR2络合物形式存在制取草酸镍(NiC2O4),工艺流程如图所示:

已知:Ⅰ:NiR2(aq)![]() Ni2+(aq)+2R-(aq) (R-为有机物配体,K=1.6×10-14)
Ni2+(aq)+2R-(aq) (R-为有机物配体,K=1.6×10-14)
Ⅱ:Ksp[Fe(OH)3]=1×10-38,Ksp[Ni(OH)2]=2×10-15
Ⅲ:“脱络”过程中,R-能与·OH(Fe2+和H2O2反应产生的中间产物)反应生成·R(有机物自由基)
①“沉铁”时,若溶液中c(Ni2+)=0.01mol·L-1,加入碳酸钠调溶液的pH=________(假设溶液体积不变)使Fe3+恰好沉淀完全(离子的浓度≤1.0×10-5mol·L-1),此时________(填“有”或“无”)Ni(OH)2沉淀生成。
②“沉镍”即得到草酸镍沉淀,其离子方程式是______________________
③NiR2中加入Fe2+和H2O2能够实现“脱络”的原因是_________________
(4)Na2SO3氧化反应:2Na2SO3+O2=2Na2SO4其反应速率受溶解氧浓度影响,分为富氧区和贫氧区两个阶段。为确定贫氧区速率方程![]() 中a的值(取整数),分析实验数据。当溶解氧浓度为4. 0 mg·L-1时,c(Na2SO3)与速率数值关系如下表,则a=______。
中a的值(取整数),分析实验数据。当溶解氧浓度为4. 0 mg·L-1时,c(Na2SO3)与速率数值关系如下表,则a=______。
![]()
【答案】升高温度或增大c(Sn2+) 构成原电池 2 3 无 Ni2++H2C2O4 =NiC2O4↓ +2H+ R-能与OH反应使NiR2(aq)![]() Ni2+(aq)+2R-(aq)中R-浓度减小,平衡向正向移动,实现“脱络” 2
Ni2+(aq)+2R-(aq)中R-浓度减小,平衡向正向移动,实现“脱络” 2
【解析】
(1)为加快反应速率可以适当升高温度、增大c(Sn2+)等,根据反应方程式,有Sn单质的生成,与Mn构成原电池,加快反应速率,故答案为:升高温度或增大c(Sn2+),构成原电池。
(2)由于c(Fe2+)=1mol·L-1,c(S2-)=![]() =
=![]() =1×10-18,又由于[H+]2·[S2-]=1.0×10-22,所以c(H+)=1×10-2mol/L,所以应调节溶液中的pH=2,故答案为:2。
=1×10-18,又由于[H+]2·[S2-]=1.0×10-22,所以c(H+)=1×10-2mol/L,所以应调节溶液中的pH=2,故答案为:2。
(3)①Ksp[Fe(OH)3]=1×10-38,则使Fe3+恰好沉淀完全所需的c(OH-)=![]() =1×10-11mol/L,此时溶液的pH=-lgc(H+)=
=1×10-11mol/L,此时溶液的pH=-lgc(H+)=![]() =3,因溶液中c(Ni2+)=0.01mol·L-1,则c(Ni2+)×c2(OH-)=0.01×(1×10-11)2=1×10-24<Ksp[Ni(OH)2],因此无Ni(OH)2沉淀生成,故答案为:3,无。
=3,因溶液中c(Ni2+)=0.01mol·L-1,则c(Ni2+)×c2(OH-)=0.01×(1×10-11)2=1×10-24<Ksp[Ni(OH)2],因此无Ni(OH)2沉淀生成,故答案为:3,无。
②“沉镍”过程中加入草酸得到草酸镍沉淀,其离子方程式是Ni2++H2C2O4 =NiC2O4↓ +2H+,故答案为:Ni2++H2C2O4 =NiC2O4↓ +2H+。
③络合物NiR2在溶液中存在以下平衡:NiR2(aq)![]() Ni2+(aq)+2R-(aq)。Fe2+与H2O2反应生成—OH,—OH与R-反应转化为难以与Ni2+络合的—R,使溶液中c(R-)减小,平衡正向移动,实现“脱络”,故答案为:R-能与OH反应使NiR2(aq)
Ni2+(aq)+2R-(aq)。Fe2+与H2O2反应生成—OH,—OH与R-反应转化为难以与Ni2+络合的—R,使溶液中c(R-)减小,平衡正向移动,实现“脱络”,故答案为:R-能与OH反应使NiR2(aq)![]() Ni2+(aq)+2R-(aq)中R-浓度减小,平衡向正向移动,实现“脱络”。
Ni2+(aq)+2R-(aq)中R-浓度减小,平衡向正向移动,实现“脱络”。
(4)当溶解氧浓度为4.0mgL-1时,c(Na2SO3)与速率数值关系如表,v1:v2=c1a(SO32-):c2a(SO32-),![]() =
=![]() ,解得a=2;故答案为:2。
,解得a=2;故答案为:2。

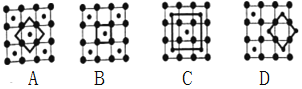
【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO, MgSO3(s) + CO(g)![]() MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
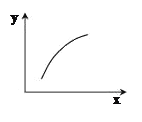
选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |