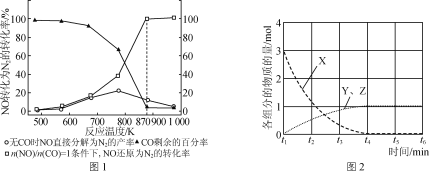
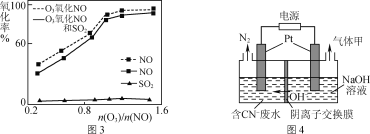
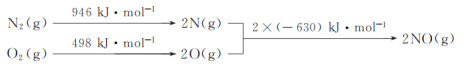题目内容
【题目】下面的排序不正确的是
A. 晶体熔点由低到高:CH4<SiH4<GeH4<SnH4
B. 熔点由高到低:Rb>K>Na
C. 硬度由大到小:金刚石>![]() 碳化硅>晶体硅
碳化硅>晶体硅
D. 晶格能由大到小:NaF> NaCl> NaBr> NaI
【答案】B
【解析】
试题A、碳族元素的氢化物都是分子晶体,熔点随相对分子质量的增大而升高,正确;B、碱金属是金属晶体,随核电荷数的增大,熔点逐渐降低,错误;C、金刚石、硅、碳化硅都是原子晶体,硬度的大小与共价键的强弱有关,原子半径小,共价键越强,所以半径由小到大:金刚石>碳化硅>晶体硅,则硬度由大到小:金刚石>碳化硅>晶体硅,正确;D、离子晶体中的晶格能与离子半径、离子的电荷数有关,离子半径越小、所带电荷越多,离子键越强,晶格能越大,卤化钠的阳离子相同,阴离子的半径随F、Cl、Br、I逐渐增大,所以晶格能由大到小:NaF>NaCl>NaBr>NaI,正确,答案选B。

练习册系列答案
相关题目