题目内容
【题目】如图所示是某学生设计的实验室制备并干燥Cl2及吸收多余氯气的实验装置图,请回答:

(1)指出上图中的各处错误:
①____________________________________________________
②____________________________________________________
③____________________________________________________
④____________________________________________________
(2)制备实验开始时,先检查装置的气密性,接下来的操作依次是 ________
A、向烧瓶中加入MnO2粉末 B、加热 C、向烧瓶中加入浓盐酸
(3)如果将过量二氧化锰与20mL 12mol·L-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06mol。其主要原因有:
①____________________________________________________
②____________________________________________________
(4)为了提高浓盐酸的利用率,你对实验的建议是:
①____________________________________________________
②____________________________________________________
(5)写出圆底烧瓶中发生反应的离子反应方程式,并用单线桥表示电子转移的方向和数目________________
(6)NaClO是84消毒液的有效成分。请回答下列问题
①浸泡衣物时加入84消毒液在空气中放置一段时间漂白效果更好,结合离子方程式解释原因 ____________(已知酸性:H2CO3 >HClO>HCO3-)
②若将84消毒液与洁厕灵(主要成分是盐酸)混合使用,则会产生黄绿色的有毒气体,其反应的离子方程式是____________________________________________;
(7)Cl2是一种有毒气体,如果泄露会造成严重的危害。
①已知:3Cl2 + 8NH3 = 6NH4Cl +N2,化工厂可用浓氨水来检验Cl2是否泄露,该反应中被氧化和未被氧化的NH3的物质的量比________ ;
②喷射石灰乳等碱性物质可以减轻少量Cl2泄露造成的危害,Cl2与石灰乳反应的化学方程式是____________
③实验室常用烧碱溶液吸收Cl2,若将Cl2通入热的烧碱溶液中,可以得到NaCl、NaClO和NaClO3的混合溶液。当NaCl和NaClO3的物质的量之比为15:2时,混合液中NaClO和NaClO3的物质的量之比为________ 。
【答案】反应试剂应使用浓盐酸,不能用稀盐酸 缺少酒精灯 除杂装置中,导管应长管进气,短管出气 生成的氯气应先通入饱和食盐水,再通入浓硫酸 ACB 加热使HCl大量挥发 盐酸变稀后不再发生反应 缓慢滴加浓盐酸 小火加热 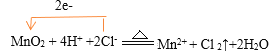 放置一段时间后,84消毒液中的NaClO可以和空气中的CO2反应,2ClO- + H2O +2CO2=2H+ + 2Cl- +O2↑ + 2HCO3- (或CO2 + H2O + ClO- =HClO + HCO3-,2HClO
放置一段时间后,84消毒液中的NaClO可以和空气中的CO2反应,2ClO- + H2O +2CO2=2H+ + 2Cl- +O2↑ + 2HCO3- (或CO2 + H2O + ClO- =HClO + HCO3-,2HClO![]() 2HCl + O2↑) Cl- + ClO- + 2H+ =Cl2 ↑+ H2O 1:3 2Ca(OH)2 + 2Cl2 = CaCl2 + Ca(ClO)2 +2H2O 5:2
2HCl + O2↑) Cl- + ClO- + 2H+ =Cl2 ↑+ H2O 1:3 2Ca(OH)2 + 2Cl2 = CaCl2 + Ca(ClO)2 +2H2O 5:2
【解析】
实验室用二氧化锰与浓盐酸加热制备氯气,浓盐酸易挥发,制备的氯气中含有氯化氢和水蒸气,依次通过盛有饱和食盐水、浓硫酸的洗气瓶除去杂质,氯气密度大于空气密度,用向上排气法收集,氯气有毒,过量的氯气应用氢氧化钠溶液吸收。
(1)①制备氯气,不能用稀盐酸,而应用浓盐酸;
②二氧化锰与浓盐酸加热制备氯气,不加热不反应,应用酒精灯加热;
③先除杂后干燥,盛浓硫酸和盛饱和食盐水的洗气瓶位置颠倒;
④两洗气瓶里进气导管和出气导管的长短不对;
(2)实验顺序是先加样品再加热,所以先检查装置的气密性,接下来的操作依次是向烧瓶中加入MnO2粉末、向烧瓶中加入浓盐酸、加热 ;
(3)加热使HCl大量挥发、盐酸变稀后不再发生反应,所以参加反应的氯化氢的物质的量小于0.24mol,生成的氯气明显少于0.06mol;
(4)为了提高浓盐酸的利用率,尽可能减少氯化氢的挥发,可以采用的方法是缓慢滴加浓盐酸、小火加热;
(5)圆底烧瓶中浓盐酸与二氧化锰在加热条件下生成氯化锰、氯气、水,反应中锰元素化合价由+4降低为+2,氯元素化合价由-1升高为0,反应的离子方程式是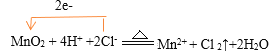 ;
;
(6)①根据强酸制取弱酸,浸泡衣物时加入84消毒液在空气中放置一段时间,次氯酸钠与空气中的二氧化碳反应生成次氯酸和碳酸氢钠,CO2 + H2O + ClO- =HClO + HCO3-,有次氯酸生成,所以漂白效果更好;
②若将84消毒液与洁厕灵(主要成分是盐酸)混合使用,次氯酸钠与盐酸发生归中反应产生氯气,反应的离子方程式是Cl- + ClO- + 2H+ =Cl2 ↑+ H2O;
(7)①3Cl2 + 8NH3 = 6NH4Cl +N2,氯元素化合价由0降低为-1,氮元素化合价由-3升高为0,根据得失电子守恒,3mol氯气氧化2mol氨气,所以该反应中被氧化和未被氧化的NH3的物质的量比2:(8-2)=1:3;
②Cl2与石灰乳反应生成次氯酸钙、氯化钙、水,反应的化学方程式是2Ca(OH)2 + 2Cl2 = CaCl2 + Ca(ClO)2 +2H2O
③设溶液中NaCl、NaClO和NaClO3的物质的量比是15:a:2,根据得失电子守恒,15×1=a×1+2×5,解得a=5,NaClO和NaClO3的物质的量之比为5:2。

【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A | B | C | D |
|
|
|
|
升高温度, | 0~3s内,反应速率为: | t1时仅加入催化剂, | 达平衡时,仅改变x,则x为c(O2) |








