题目内容
【题目】完成下列化学用语:
(1)画出 O2﹣结构示意图:_____,某种核素质量数 37,中子数 20,其原子符号:_____
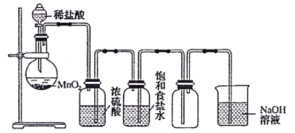
(2)写出实验室制氯气的化学方程式:______________________
(3)工厂里常用浓氨水来检验氯气管道是否泄漏,其原理为:8NH3+3Cl2=6NH4Cl+N2,请用双线桥表示其电子转移的方向和数目__________________________________
【答案】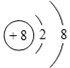
![]() MnO2+4HCl(浓)
MnO2+4HCl(浓) ![]() MnCl2+C12↑+2H2O
MnCl2+C12↑+2H2O 
【解析】
(1)O2﹣核外有10个电子;某种核素质量数为 37、中子数为 20,质子数是17,属于氯元素。
(2)实验室用二氧化锰和浓盐酸加热制取氯气;
(3)8NH3+3Cl2=6NH4Cl+N2反应中氯元素化合价由0降低为-1,氮元素化合价由-3升高为0。
(1)O2﹣核外有10个电子,结构示意图是 ;某种核素质量数为 37、中子数为 20,质子数是17,属于氯元素,原子符号是
;某种核素质量数为 37、中子数为 20,质子数是17,属于氯元素,原子符号是![]() 。
。
(2)二氧化锰和浓盐酸加热生成氯化锰、氯气、水,反应方程式是MnO2+4HCl(浓) ![]() MnCl2+C12↑+2H2O;
MnCl2+C12↑+2H2O;
(3)8NH3+3Cl2=6NH4Cl+N2反应中氯元素化合价由0降低为-1,氮元素化合价由-3升高为0,电子转移的方向和数目是 。
。

练习册系列答案
相关题目