题目内容
【题目】下列说法正确的是
A.反应CaCO3(s)=CaO(s)+CO2(g),在常温下不能自发进行,则该反应的△H<0
B.0.lmol·L一1CH3COOH溶液加水稀释后,溶液中 的值减小
的值减小
C.铅蓄电池在放电过程中,负极质量增加,正极质量减少
D.锅炉中沉积的CaSO4和BaSO4都可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去
【答案】D
【解析】
A、由方程式可知△S>0,如反应能自发进行,则应满足△H-T△S<0,而常温下不能进行,则△H>0,故A错误;
B、醋酸为弱电解质,加水稀释促进电离,则n(CH3COOH)减小,n(CH3COO-)增大,故溶液中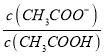 的值增大,故B错误;
的值增大,故B错误;
C、铅蓄电池在放电过程中,负极电极反应式Pb+SO42--2e-=PbSO4,负极质量减少,正极电极反应式为PbO2+4H++SO42-+2e-=PbSO4+2H2O正极质量减少,故C错误;
D、长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率.水垢中含有的CaSO4,可先用Na2CO3溶液处理,CO32-与Ca2+生产更难溶的CaCO3沉淀,使CaSO4的沉淀溶解平衡向右移,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去,故D正确;
故选D。

练习册系列答案
相关题目