题目内容
【题目】NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.0.1mol/L NaCI溶液中所含Na+数目为0.1NAB.1mol NH3所含有的原子数为NA
C.标准状况下,22.4L水中所含原子数为3NAD.常温常压下,48g O3所含的原子数为3NA
【答案】D
【解析】
A项、题中没有告诉溶液的体积,无法计算.1mol/L NaCI溶液中NaCI的物质的量,故A错误;
B项、氨气为四原子分子,1mol 氨气分子中所含有的原子数为4NA,故B错误;
C项、标况下水不是气体,不能使用标况下的气体摩尔体积计算2.24L水的物质的量,故C错误;
D项、常温常压下,48g O3的物质的量为![]() =1mol,1mol臭氧所含的原子数为3NA,故D正确;
=1mol,1mol臭氧所含的原子数为3NA,故D正确;
故选D。

 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案【题目】甲醇是重要的化工原料,在有机合成中具有广泛应用。
I.(1)用甲醇制取甲胺的反应为![]() △H
△H
已知该反应中相关化学键的键能数据如下:
共价键 | C―O | H―O | N―H | C―N |
键能/kJ·mol-1 | 351 | 463 | 393 | 293 |
则该反应的△H=__________kJ·mol-1
Ⅱ.一定条件下,将2mol CO和6mol H2通入2L密闭容器中发生如下反应
主反应:![]() △H<0 Ⅰ
△H<0 Ⅰ
副反应:![]() △H<0 Ⅱ
△H<0 Ⅱ
反应到t min时,达到平衡状态。平衡时CH3OH的体积分数φ(CH3OH)如图所示:
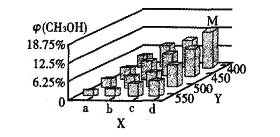
(2)图中a___b(填“大于”或“小于”)。图中Y轴表示温度,其理由是__________
(3)若反应II的平衡常数K值变小.则下列说法中正确的是___________(填序号)。
A.平衡均向正反应方向移动
B.平衡移动的原因是升高了温度
C.达到新平衡后,φ(CH3OH)减小
D.容器中φ(CH3OCH3)增大
(4)平衡时,M点CH3OH的体积分数为12.5%,c(CH3OCH3)=0.1mol·L-1,则此时CO的转化率为________;用H2表示I的反应速率为______mol·L-1·min-1。反应Ⅱ的平衡常数K=___________(用分数表示)



