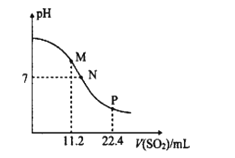
题目内容
【题目】化学作为一门基础自然科学,在材料科学、生命科学、能源科学等诸多领域发挥着重要作用,其中铁和铜是两种应用广泛的元素。
(1)基态铁原子的价电子轨道表达式为_____。
(2)磁性材料铁氧体在制备时常加入 CH3COONa、尿素[CO(NH2)2]等碱性物质。尿素分子中所含元素的电负性由小到大的顺序是_____,1mol 尿素分子中含有的 σ 键数目为_____。 CH3COONa 中碳原子的杂化类型为_________。
(3)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则 Fe(CO)5的晶体类型是_____,写出与CO互为等电子体的分子的电子式_____(任写一种)。
(4)CuO在高温时分解为 O2和 Cu2O,请从阳离子的结构来说明在高温时,Cu2O比 CuO更稳定的原因_____。
(5)磷青铜是含少量锡、磷的铜合金,某磷青铜晶胞结构如图所示:
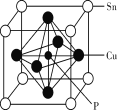
①其化学式为_____。
②若晶体密度为 8.82g/cm3,则最近的 Cu原子核间距为_____pm(用含 NA 的代数式表示)。
【答案】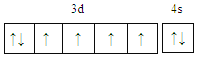 H<C<N<O 7NA sp3、sp2 分子晶体
H<C<N<O 7NA sp3、sp2 分子晶体 ![]() Cu+的最外层电子排布为3d10,Cu2+的最外层电子排布为3d9,最外层电子排布为全满时稳定,Cu2O比 CuO更稳定 SnCu3P
Cu+的最外层电子排布为3d10,Cu2+的最外层电子排布为3d9,最外层电子排布为全满时稳定,Cu2O比 CuO更稳定 SnCu3P 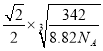 ×1010pm
×1010pm
【解析】
(1)Fe基态原子价电子排布式3d64s2,则基态铁原子的价电子轨道表达式为 ;故答案为:
;故答案为: ;
;
(2)同周期元素从左到右电负性增强,尿素[CO(NH2)2]分子中所含元素的电负性由小到大的顺序是H<C<N<O,尿素的结构如图 ,分子中含有4个N-H键、2个C-N键,一个C-O键,1mol 尿素分子中含有的 σ 键数目为7NA。根据VSEPR理论,CH3COONa 中甲基中的C原子:VP=BP+LP=4+0=4,中心C为sp3杂化,羧基中的C原子:VP=BP+LP=3+
,分子中含有4个N-H键、2个C-N键,一个C-O键,1mol 尿素分子中含有的 σ 键数目为7NA。根据VSEPR理论,CH3COONa 中甲基中的C原子:VP=BP+LP=4+0=4,中心C为sp3杂化,羧基中的C原子:VP=BP+LP=3+![]() =3,中心C为sp2杂化,故 CH3COONa 中碳原子的杂化类型为sp3、sp2。故答案为:H<C<N<O;7NA;sp3、sp2;
=3,中心C为sp2杂化,故 CH3COONa 中碳原子的杂化类型为sp3、sp2。故答案为:H<C<N<O;7NA;sp3、sp2;
(3)Fe(CO)5又名羰基铁,常温下为黄色油状液体,熔点比较低,则 Fe(CO)5的晶体类型是分子晶体;等电子体是指具有相同价电子数目和原子数目的分子或离子,与CO互为等电子体的分子为N2,电子式为:![]() 。故答案为:分子晶体;
。故答案为:分子晶体;![]() ;
;
(4)CuO在高温时分解为 O2和 Cu2O,从阳离子的结构来看,Cu2O比 CuO更稳定的原因是:Cu+的最外层电子排布为3d10,Cu2+的最外层电子排布为3d9,最外层电子排布为全满时稳定,Cu2O比 CuO更稳定。故答案为:Cu+的最外层电子排布为3d10,Cu2+的最外层电子排布为3d9,最外层电子排布为全满时稳定,Cu2O比 CuO更稳定。
(5)①晶体中P原子位于中心,含有一个磷原子,立方体每个面心有一个Cu,每个Cu分摊给一个晶胞的占![]() ,立方体顶角Sn分摊给每个晶胞的原子为
,立方体顶角Sn分摊给每个晶胞的原子为![]() ,据此得到化学式SnCu3P,故答案为:SnCu3P;
,据此得到化学式SnCu3P,故答案为:SnCu3P;
②SnCu3P的摩尔质量为342g·mol-1,则一个晶胞质量m=![]() g,设立方体边长为x,铜原子间最近距离为a,则a2=(
g,设立方体边长为x,铜原子间最近距离为a,则a2=(![]() )2+(
)2+(![]() )2,a=
)2,a=![]() x,结合密度ρ=
x,结合密度ρ=![]() ,V=x3=
,V=x3=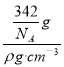 =
= cm,故答案为:
cm,故答案为: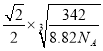 ×1010pm。
×1010pm。

【题目】利用一种钴矿石(主要成分为 Co2O3,含少量 SiO2及铁、铝、锰、镁、钙等金属元素的氧化物)制取CoC2O42H2O 晶体的工艺流程如下:

已知部分阳离子以氢氧化物形式沉淀时溶液 pH 如表
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀的 pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)溶浸过程中 Co2O3 发生反应的离子方程式为_____。
(2)氧化除杂过程中加入 Na2CO3 的主要目的是__________,若不加入 NaClO3,其后果是_____。
(3)滤渣 3 的成分是____________,滤液中加入萃取剂的目的是除去_________元素(填元素符号)。
(4)萃取余液中加入草酸铵后,获取 CoC2O4·2H2O 晶体的操作是___________。
(5)含钴化合物 LiCoO2是废旧锂电池的正极材料,可与双氧水、稀 H2SO4 混合加热得到 CoSO4回收利用,该过程发生反应的化学方程式是____________。
(6)已知某温度下 Ksp(MgF2)=7.35×10-11,Ksp(CaF2)=1.05×10-10,当加入过量NaF溶液后,所得滤液中c(Ca2+)/c(Mg2+) =___________。
【题目】下表是三种难溶金属硫化物的溶度积常数(25℃):
化学式 | FeS | CuS | MnS |
溶度积 | 6.3×10-18 mol2·L-2 | 1.3×10-36 mol2·L-2 | 2.5×10-13 mol2·L-2 |
下列有关说法中正确的是
A.25℃时,CuS 的溶解度大于 MnS 的溶解度
B.除去某溶液中的 Cu2+,可以选用 FeS 作沉淀剂
C.因为 H2SO4 是强酸,所以反应 CuSO4+H2S = CuS↓+H2SO4不能发生
D.25℃时,饱和 CuS 溶液中,Cu2+的浓度为 1.3×10-36 mol·L-1