题目内容
【题目】高氯酸钠可用于制备高氯酸。以精制盐水等为原料制备高氯酸钠晶体(NaClO4·H2O)的流程如下:
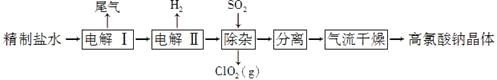
(1)由粗盐(含Ca2+、Mg2+、SO42-、Br-等杂质)制备精制盐水时需用到NaOH、BaCl2、Na2CO3等试剂。Na2CO3的作用是____________;除去盐水中的Br-可以节省电解过程中的电能,其原因是________________。
(2)“电解Ⅰ”的目的是制备NaClO3溶液,产生的尾气除H2外,还含有______________(填化学式)。“电解Ⅱ”的化学方程式为_____________________。
(3)“除杂”的目的是除去少量的NaClO3杂质,该反应的离子方程式为_______________________。“气流干燥”时,温度控制在80~100 ℃的原因是__________________。
【答案】除去Ca2+和引入的Ba2+ 电解时Br-被氧化 Cl2 NaClO3+H2O![]() NaClO4+H2↑ 2ClO3-+SO2=2ClO2+SO42- 温度太高,高氯酸钠晶体失去结晶水或分解;温度太低,干燥不充分
NaClO4+H2↑ 2ClO3-+SO2=2ClO2+SO42- 温度太高,高氯酸钠晶体失去结晶水或分解;温度太低,干燥不充分
【解析】
(1)粗盐的提纯中:Ca2+用CO32-除去、Mg2+用OH-除去、SO42-用Ba2+除去,除杂过程中过量除杂试剂必须除去,过量NaOH用盐酸除去,过量的Ba2+用CO32-除去,过量CO32-用盐酸除去,碳酸钠的作用除去Ca2+和引入的Ba2+,根据电解池的放电顺序,放电顺序:Br->Cl-,除去Br-,在电解过程中直接电解Cl-,节省电能,因此原因:电解时Br-被氧化;
(2)根据题意,在阳极上Cl-放电生成ClO3-,也有可能放电生成Cl2,阴极上2H2O+2e-=H2↑+2OH-,尾气中除含有氢气外,可能含有氯气,电解Ⅱ产生高氯酸钠,阳极上电极反应式:ClO3-+H2O-2e-=ClO4-+2H+,阴极上电极反应式:2H++2e-=H2↑,两式合并:ClO3-+H2O![]() ClO4-+H2↑,反应方程式:NaClO3+H2O
ClO4-+H2↑,反应方程式:NaClO3+H2O![]() NaClO4+H2↑;
NaClO4+H2↑;
(3)根据信息:SO2被氧化,ClO3-→ClO2,ClO3-+SO2→ClO2↑+SO42-,根据化合价升降法配平,其离子反应方程式为:2ClO3-+SO2=2ClO2+SO42-,实验目的是制备NaClO4·H2O,温度过高,高氯酸钠晶体会失去结晶水,或温度过高,高氯酸钠分解,如果温度过低,干燥不充分。

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案