题目内容
【题目】氮化钛广泛用于耐高温、耐磨损及航空航天等领域。一种氮化钛的制备反应为:6TiCl4+8NH3=6TiN+24HCl+N2,回答下列问题:
(1)钛在元素周期表中的位置为_____________,基态Ti原子价层电子的轨道表达式为________。
(2)氮可与其他元素形成正离子,如NH4Cl中的NH4+,N2O5中的NO2+。组成这两种正离子的元素中第一电离能由小到大的顺序为____________;NH4+的空间构型为___________;NO2+中氮原子的杂化形式为_______,其中σ键与π键的数目比为_________。
(3)四氯化钛晶体的熔点为-23℃,沸点为136℃,则TiCl4晶体的类型为___________,该晶体中微粒之间的作用力为___________。
(4)一种TiN金黄色晶体晶胞结构与NaCl相同(如图),该晶胞中N原子数目为_______;该氮化钛的密度为5.4g/cm3,则其晶胞参数a=___________pm(用NA表示阿伏加德常数的数值,只列算式)。

【答案】第4周期ⅣB族 ![]() H<O<N 正四面体 sp 1:1 分子晶体 范德华力 4
H<O<N 正四面体 sp 1:1 分子晶体 范德华力 4 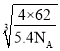 ×1010
×1010
【解析】
(1)Ti原子为22号元素,Ti位于第四周期IV B族,基态原子价层电子排布式为3d24s2,其价层电子的轨道表达式为![]() ;
;
(2)组成这两种正离子的元素为H、N、O,根据元素周期律,同周期元素从左向右第一电离能增大,但第ⅤA族的元素由于最外层处于半满状态,是一种稳定结构,所以第一电离能高于相邻的同周期其它元素,所以N、O、H第一电离能由小到大的顺序是H<O<N;NH4+中心原子N有4个相同的σ键,属于sp3杂化,NH4+的空间构型为正四面体形;NO2+中氮原子价层电子对数为2,没有孤电子对,N的杂化方式为sp杂化,分子为直线形,形成两个氮氧双键,所以σ键与π键的数目比为1:1;
(3)分子晶体的熔沸点较低,该物质熔沸点较低,属于分子晶体,微粒间作用力为分子间作用力;
(4)TiN中Ti和N原子数目之比为1:1,结构与NaCl相同,该晶胞中N原子数目为8×![]() +6×
+6×![]() =4,Ti原子数目为12×
=4,Ti原子数目为12×![]() +1=4,晶胞质量m=
+1=4,晶胞质量m=![]() ,晶胞体积V=a3=
,晶胞体积V=a3=![]() ,所以a=
,所以a=![]() 。
。

【题目】下列有关实验操作、现象和解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 过量的Fe粉中加入HNO3, | 溶液呈红色 | 稀HNO3将Fe氧化为 |
B | AgI沉淀中滴入稀KCl溶液 | 有白色沉淀出现 | AgCl比AgI更难溶 |
C | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
【题目】(1)下列数据是对应物质的熔点(℃)
NaCl | Na2O | AlF3 | AlCl3 | BCl3 | Al2O3 | CO2 | SiO2 |
801 | 920 | 1291 | 190 | -109 | 2073 | -57 | 1723 |
据此作出的下列判断中,错误的是_____。
A 铝的化合物晶体中不存在离子晶体
B 表中只有BCl3、干冰是分子晶体
C 同族元素的氧化物可形成不同类型的晶体
D 不同族元素的氧化物可形成不同类型的晶体
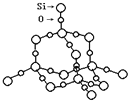
(2)SiO2晶体结构片断如图所示。SiO2晶体中Si原子数目和Si﹣O键数目的比例为_____。
通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能。
化学键 | Si-O | Si-Si | O=O |
键能/KJmol-1 | 460 | 176 | 498 |
Si(s)+ O2(g)=SiO2(s),该反应的反应热△H=__________。
(3)单质铝晶体晶胞特征如图乙所示.则晶胞中铝原子的配位数为_____,晶胞中存在两种空隙,分别是___________、___________。