题目内容
9.填写下表| 物质(杂质) | 除去杂质 所需试剂或方法 | 离子方程式(若无离子方程式,则写化学方程式) |
| Fe(Al) | ||
| CO2(HCl) | ||
| NaHCO3溶液(Na2CO3) | ||
| Al2O3(Al(OH)3) |
分析 二者铝能够与氢氧化钠溶液反应生成偏铝酸钠和水,铁不反应;
盐酸能够与饱和碳酸氢钠反应生成二氧化碳,二氧化碳在饱和碳酸钠溶液中溶解度较小;
碳酸钠溶液与二氧化碳和水反应生成碳酸氢钠;
氢氧化铝受热分解生成氧化铝和水.
解答 解:铝能够溶于氢氧化钠,反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑,铁不能,可以选择氢氧化钠溶液除去铝;
盐酸能够与饱和碳酸氢钠反应生成二氧化碳,反应的离子方程式:HCO3-+H+=H2O+CO2↑,二氧化碳在饱和碳酸钠溶液中溶解度较小,可以选择饱和碳酸氢钠溶液除去氯化氢;
碳酸钠溶液与二氧化碳和水反应生成碳酸氢钠,反应的离子方程式:CO32-+CO2+H2O=2HCO3-,可以通入足量的二氧化碳除去碳酸钠;
氢氧化铝受热分解生成氧化铝和水,化学方程式:2Al(OH)3=3H2O+Al2O3,可以通过加热除去氢氧化铝,
故答案为:
| 物质(杂质) | 除去杂质所需试剂或方法(1分) | 离子或化学方程式(1分) |
| Fe(Al) | 氢氧化钠溶液 | 2Al+2OH-+2H2O=2AlO2-+3H2↑ |
| CO2(HCl) | 饱和碳酸氢钠溶液 | HCO3-+H+=H2O+CO2↑ |
| NaHCO3溶液(Na2CO3) | CO2 | CO32-+CO2+H2O=2HCO3- |
| Al2O3(Al(OH)3) | 加热分解 | 2Al(OH)3=3H2O+Al2O3 |
点评 本题以除杂为载体考查了离子方程式的书写,明确物质的性质及除杂原则是解本题关键,注意除杂不能引入新的杂质离子,题目难度不大.

练习册系列答案
相关题目
19.下列各组物质中,既不是同系物,又不是同分异构体的是( )
| A. | CH4和C4H10 | B. | 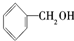 和 和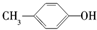 | C. | 乙酸和甲酸甲酯 | D. | 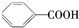 和 和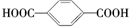 |
20.若NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 20g重水(2H2O)含有10NA个电子 | |
| B. | 常温常压下,1摩氦气含有2NA个原子 | |
| C. | 100mL 1mol/L NaHCO3 溶液含有0.1NA个HCO3- | |
| D. | 5.6g金属铁与足量稀盐酸反应完全反应时,失去 0.3NA个电子 |
18.用惰性电极电解浓度为0.1mol/L的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1molCu(OH)2和9gH2O时,恰好恢复电解前的浓度和pH.则下列说法正确的是( )
| A. | 电解过程中共转移电子1.4mol | |
| B. | 原硫酸铜溶液的体积为1L | |
| C. | 在这个过程中共生成6.4gCu和0.5molO2 | |
| D. | 电解过程中阴极有0.3molH2生成 |
19.下列关于化学平衡常数的说法中错误的是( )
| A. | 化学平衡常数K随温度的升高,K可能增大、减小或不变 | |
| B. | 催化剂不能改变平衡常数的大小 | |
| C. | 对于给定的可逆反应,温度一定时,其正、逆反应的平衡常数可能相等 | |
| D. | 化学平衡移动时,平衡常数不一定改变 |
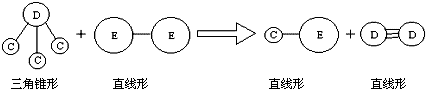
 ;
;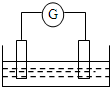 如图是常见原电池装置,电流表G发生偏转:
如图是常见原电池装置,电流表G发生偏转: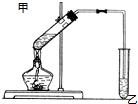 如图在试管甲中先加入2mL 95%的乙醇,再加入2克无水乙酸,充分摇匀,并在摇动下缓缓加入2mL浓硫酸,冷却后,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5ml 饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.试回答:
如图在试管甲中先加入2mL 95%的乙醇,再加入2克无水乙酸,充分摇匀,并在摇动下缓缓加入2mL浓硫酸,冷却后,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5ml 饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.试回答: CH3COOC2H5+H2O
CH3COOC2H5+H2O