题目内容
12.元素R的质量数为A,Rn-的核外电子数为x,则ngRn-所含中子的物质的量为( )| A. | (A-x+n)mol | B. | (A-x-n)mol | C. | (A-x+n)n/Amol | D. | (A-x-n)n/Amol |
分析 根据阴离子核外电子数=质子数+所带电荷数计算元素R的质子数,由中子数=质量数-质子数计算Rn-含有的中子数,再根据n=$\frac{m}{M}$计算ngRn-的物质的量,结合Rn-含有的中子数,进而计算含有的中子的物质的量.
解答 解:Rn-的核外电子数为x,所以质子数为x-n,
元素R的质量数为A,所以中子数为A-(x-n)=A-x+n,
所以ngRn-所含中子的物质的量为$\frac{ng}{Ag/mol}$×(A-x+n)=$\frac{n(A-x+n)}{A}$mol.
故选C.
点评 本题考查物质的量计算、微粒中粒子之间关系,注意元素的近似相对原子质量等于质量数.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.若NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 20g重水(2H2O)含有10NA个电子 | |
| B. | 常温常压下,1摩氦气含有2NA个原子 | |
| C. | 100mL 1mol/L NaHCO3 溶液含有0.1NA个HCO3- | |
| D. | 5.6g金属铁与足量稀盐酸反应完全反应时,失去 0.3NA个电子 |
7.根据键能数据:H-Cl 431kJ/mol,H-I 299kJ/mol,由此可得出的结论是( )
| A. | 溶于水时,HI分子比HCl分子更容易电离 | |
| B. | HI比HCl熔、沸点都高 | |
| C. | HI比HCl更稳定 | |
| D. | 拆开相同物质的量的HI分子比HCl消耗的能量小,HI是离子化合物 |
2.根据下列化学实验示意图及表中实验现象,从理论上分析得出的结论正确的是( )
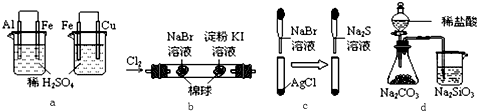

| 选项 | 实验 | 实验现象 | 结论 |
| A | a | 左烧杯中铁表面有气泡,右烧杯中铜表面有气泡 | 活动性:Al>Fe>Cu |
| B | b | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
| C | c | 白色固体先变为淡黄色,后变为黑色 | 溶解度:AgCl<AgBr<Ag2S |
| D | d | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
| A. | A | B. | B | C. | C | D. | D |
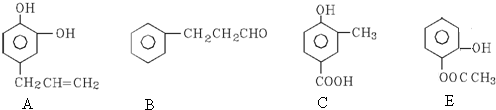
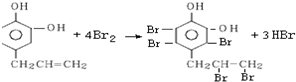 .
. .
. .
.
 ;
; 如图在试管甲中先加入2mL 95%的乙醇,再加入2克无水乙酸,充分摇匀,并在摇动下缓缓加入2mL浓硫酸,冷却后,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5ml 饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.试回答:
如图在试管甲中先加入2mL 95%的乙醇,再加入2克无水乙酸,充分摇匀,并在摇动下缓缓加入2mL浓硫酸,冷却后,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5ml 饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.试回答: CH3COOC2H5+H2O
CH3COOC2H5+H2O