题目内容
【题目】硝基苯是重要的化工原料,用途广泛。制备反应如下:
![]()

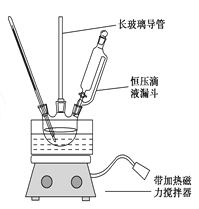
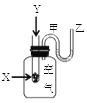
组装如右上图反应装置。 制备、提纯硝基苯流程如下:

可能用到的有关数据列表如下:
物 质 | 熔点/℃ | 沸点/℃ | 密度(20 ℃)/g · cm-3 | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
浓硝酸 | — | 83 | 1.4 | 易溶于水 |
浓硫酸 | — | 338 | 1.84 | 易溶于水 |
请回答下列问题:
(1)配制混酸应在烧杯中先加入 ;实验装置中长玻璃管最好用________代替(填仪器名称);恒压滴液漏斗的优点是 。
(2)反应温度控制在50~60 ℃的原因是 ;反应结束后产物在 层(填“上”或者“下”),步骤②分离混酸和产品的操作名称是 。
(3)用Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净? 。
(4)固体D的名称为 。
(5)用铁粉、稀盐酸与硝基苯(用Ph-NO2表示 )反应可生成染料中间体苯胺(Ph-NH2),其反应的化学方程式为 。
【答案】(1)浓硝酸;球形冷凝管(或蛇形冷凝管,);使混合酸能顺利流下
(2)防止副反应发生 上 分液
(3)取最后一次洗涤液,向溶液中加入氯化钙,无沉淀生成,说明已洗净
(4)无水氯化钙或无水硫酸镁 (5)C6H5NO2+3Fe+6HCl→C6H5NH2+3FeCl2+2H2O
【解析】试题分析:(1)由于浓硫酸的密度比浓硝酸的大,当浓硫酸遇水时放出大量的热,所以配置混酸应将浓硫酸加入到浓硝酸中,也就是先在烧杯中先加入浓硝酸。在实验的过程中苯、硝酸会因为加热而气化,导致物质的浪费与环境污染,所以在装置中长玻璃管可以起到冷凝、降温使物质回流的作用。因此实验装置中长玻璃管最好用球形冷凝管或蛇形冷凝管代替;又因为在反应的过程中不断加热,会产生大量的气体,这对于液体的加入很不利。若采用恒压滴液漏斗滴加,可以保持漏斗内压强与发生器内压强相等,使漏斗内液体能顺利流下。
(2)反应温度控制在50~60 ℃的原因是防止副反应发生;反应结束后产生的硝基苯、1,3-二硝基苯都是不溶解于水的液体,密度比酸的混合溶液小。所以反应结束后产品在液体的上层,分离互不相溶的两层液体的方法是分液。
(3)对于得到的粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后再用蒸馏水洗涤。如果洗涤干净,则洗涤液中不含有CO32-。所以检验液体已洗净的方法是取最后一次洗涤液,向溶液中加入氯化钙,若无沉淀生成,说明已洗净。
(4)固体D是为了除去残留的水,为了得到更纯净的硝基苯,使之不含有水,可以先向液体中加入有吸水干燥作用的无水氯化钙或无水硫酸镁。
(5)反应中硝基被铁还原为铵根,则反应的方程式为C6H5NO2+3Fe+6HCl→C6H5NH2+3FeCl2+2H2O。

 阅读快车系列答案
阅读快车系列答案【题目】利用含铜、铁的粗锌制备硫酸锌及相关物质。工艺流程图及有关数据如下:

物质 | Cu(OH)2 | Zn(OH)2 | Fe(OH)3 | ZnS | CuS |
Ksp | 5.0×10-20 | 2.0×10-16 | 4.0×10-38 | 1.2×10-23 | 8.5×10-45 |
请回答下列问题:
(1)粗锌中的铜与混酸的稀溶液反应的化学方程式为__________________________,图中处理气体X要能够体现绿色化学思想,还需补充气体______(填化学式)。
(2)若溶液I中c(Cu2+)为0.05mol·L-1,则溶液II中c(Fe3+)>____mol·L-1。
(3)若固体A是Zn,取9.61 g固体C溶解于足量的500mL 2 mol·L-1稀硝酸中,共收集到标准状况下2.24L的气体,向所得溶液中加入2 mol·L-1NaOH溶液,则当生成沉淀最多时,沉淀的质量为_____g;若固体A是另一种物质,取部分固体C于试管中,加入盐酸产生有臭鸡蛋味气体,则该反应的离子方程式为________________________。
(4)溶液Ⅲ经过蒸发浓缩、____________、过滤、洗涤、干燥,即得到较纯净的硫酸锌晶体;溶液还可以制备ZnS,实际选择的是(NH4)2S溶液而不是Na2S溶液作为反应物,理由是后者制得的ZnS含有较多的杂质,则该杂质是____________(填化学式)。
(5)金属锌常用作酸性干电池的负极,干电池不使用时,由于负极与电解质溶液接触而发生自放电反应:2NH4++Zn=2NH3+H2↑+Zn2+,造成电量自动减少。写出铅蓄电池不使用时,其正极上发生自放电的化学方程式__________________________。