题目内容
【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白(涉及表中元素一律用对应化学符号表示):
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的是:________(填具体元素符号,下同),原子结构示意图为________。元素⑩名称为________在周期表中的位置________。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是________,碱性最强的化合物的电子式是:________。
(3)用电子式表示元素④与⑥的化合物的形成过程:________________,该化合物属于________(填“共价”或“离子”)化合物。
(4)表示①与⑦的化合物的电子式________,该化合物是由________(填”极性”、“非极性”)键形成的。
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是______________。
(6)元素③的氢化物的结构式为________;该氢化物常温下和元素⑦的单质反应的化学方程式为_________ _____。
【答案】(1)Ar  溴 第四周期第ⅦA族
溴 第四周期第ⅦA族
(2)HClO4 ![]()
(3)![]() 离子
离子
(4)  极性(5)S2->Cl->O2-
极性(5)S2->Cl->O2-
(6)H—O—H Cl2+H2O===HClO+HCl
【解析】
试题分析:根据元素周期表分析,①为碳,②为氮,③为氧,④为钠,⑤为铝,⑥为硫,⑦为氯,⑧为氩,⑨为钾,⑩为溴。
(1)这些元素中氩化学性质最不活泼,其原子结构示意图为  元素⑩为溴,在元素周期表的第四周期第ⅦA族。(2)高氯酸是最强酸,化学式为HClO4 ,碱性最强的为氢氧化钾,电子式为:
元素⑩为溴,在元素周期表的第四周期第ⅦA族。(2)高氯酸是最强酸,化学式为HClO4 ,碱性最强的为氢氧化钾,电子式为: ![]()
(3)用电子式表示硫化钠的形成过程为: ![]() ;硫化钠含有离子键,属于离子化合物。(4)碳和氯形成四氯化碳,其电子式为
;硫化钠含有离子键,属于离子化合物。(4)碳和氯形成四氯化碳,其电子式为  含有极性键。(5)氧离子,硫离子,和氯离子的比较,氧离子有2层,硫离子和氯离子有3层,层数相同,核电荷数越大,半径越小,层数越多,半径越大,故半径顺序为S2->Cl->O2-。(6)氧元素形成的氢化物为水,结构式为:H—O—H,水和氯气反应生成盐酸和次氯酸,方程式为:Cl2+H2O===HClO+HCl(用
含有极性键。(5)氧离子,硫离子,和氯离子的比较,氧离子有2层,硫离子和氯离子有3层,层数相同,核电荷数越大,半径越小,层数越多,半径越大,故半径顺序为S2->Cl->O2-。(6)氧元素形成的氢化物为水,结构式为:H—O—H,水和氯气反应生成盐酸和次氯酸,方程式为:Cl2+H2O===HClO+HCl(用![]() 也对,2分)
也对,2分)

【题目】硝基苯是重要的化工原料,用途广泛。制备反应如下:
![]()

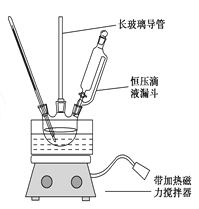
组装如右上图反应装置。 制备、提纯硝基苯流程如下:

可能用到的有关数据列表如下:
物 质 | 熔点/℃ | 沸点/℃ | 密度(20 ℃)/g · cm-3 | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
浓硝酸 | — | 83 | 1.4 | 易溶于水 |
浓硫酸 | — | 338 | 1.84 | 易溶于水 |
请回答下列问题:
(1)配制混酸应在烧杯中先加入 ;实验装置中长玻璃管最好用________代替(填仪器名称);恒压滴液漏斗的优点是 。
(2)反应温度控制在50~60 ℃的原因是 ;反应结束后产物在 层(填“上”或者“下”),步骤②分离混酸和产品的操作名称是 。
(3)用Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净? 。
(4)固体D的名称为 。
(5)用铁粉、稀盐酸与硝基苯(用Ph-NO2表示 )反应可生成染料中间体苯胺(Ph-NH2),其反应的化学方程式为 。







