题目内容
一定条件下,在一固定容积密闭容器中发生如下反应:N2(g)+3H2(g) 2NH3(g),若开始时只充入2a mol NH3,达到平衡时,混合气体的压强比起始时增大了40%。若开始时充入a mo N2和3a mol H2的混合气体,求:
2NH3(g),若开始时只充入2a mol NH3,达到平衡时,混合气体的压强比起始时增大了40%。若开始时充入a mo N2和3a mol H2的混合气体,求:
(1)达到平衡时H2的转化率;
(2)平衡时NH3在混合气体中的体积分数。
 2NH3(g),若开始时只充入2a mol NH3,达到平衡时,混合气体的压强比起始时增大了40%。若开始时充入a mo N2和3a mol H2的混合气体,求:
2NH3(g),若开始时只充入2a mol NH3,达到平衡时,混合气体的压强比起始时增大了40%。若开始时充入a mo N2和3a mol H2的混合气体,求:(1)达到平衡时H2的转化率;
(2)平衡时NH3在混合气体中的体积分数。
60%;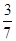 (或42.9%)
(或42.9%)
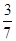 (或42.9%)
(或42.9%)试题分析:(1)N2 (g)+3H2(g)
 2NH3 (g)
2NH3 (g)起始量(mol) 0 0 2a
转化量(mol) x 3x 2x
平衡量(mol) x 3x (2a-2x)
所以根据题意可知
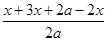 =1.4
=1.4解得x=0.4a
若开始时充入a mol N2和3a mol H2的混合气体,达到平衡时,与开始充入2a mol NH3平衡等效
所以反应的H2的物质的量为:3a-3x=3a-3×0.4a=1.8a mol
所以H2的转化率为
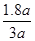 ×100% =60%
×100% =60%(2)NH3在混合气体中的体积分数:
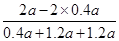 =
=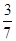 (或42.9%)
(或42.9%)
练习册系列答案
相关题目
 CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经测定该反应在该温度下的平衡常数K=1,试判断:
CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经测定该反应在该温度下的平衡常数K=1,试判断: PCl5(g)有关数据如下,下列判断不正确的是
PCl5(g)有关数据如下,下列判断不正确的是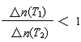
 Y(g)+Z(s),以下能说明反应达到平衡标志的是( )
Y(g)+Z(s),以下能说明反应达到平衡标志的是( ) 2AB3(g) 达到平衡的标志是
2AB3(g) 达到平衡的标志是 2NH3(g) △H<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
2NH3(g) △H<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题: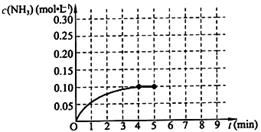
 2NH3(g) △H=-92.4 kJ/mol
2NH3(g) △H=-92.4 kJ/mol v正(NH3)=v逆(H2)
v正(NH3)=v逆(H2)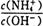 值将_____(填“增大”, “减小” 或“不变”)。
值将_____(填“增大”, “减小” 或“不变”)。 H2+CO2。向容器内加入1molCO和1mol H2O(g)时,生成2/3mol CO2如果通入的H2O(g)改为4mol时,在上述条件下,生成CO2的物质的量为
H2+CO2。向容器内加入1molCO和1mol H2O(g)时,生成2/3mol CO2如果通入的H2O(g)改为4mol时,在上述条件下,生成CO2的物质的量为