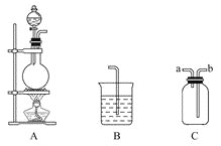
题目内容
【题目】已知:A(g)+2B(g) ![]() 2C(g),恒温恒压下,在密闭容器中充入1 mol A和2 mol B后的容积为3L。
2C(g),恒温恒压下,在密闭容器中充入1 mol A和2 mol B后的容积为3L。
(1)下列能用于判断该反应达到平衡的是(填字母):__________________。
a.A、B的浓度之比为1∶2 b.容器内气体的总物质的量不变
c.容器内气体密度不再变化 d.生成0.2 mol A的同时生成0.2 mol C
(2)平衡后,再向容器中通入1 mol氦气,A的转化率___________(填“增大”、“不变”、“减小”)。
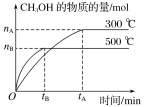
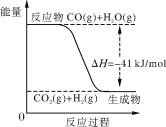
(3)在T1、T2不同温度下,C的体积分数与时间关系如图所示。则T1 ______T2(填“大于”或“小于”,下同),该反应的△H __________0。若在T1下达到平衡,K(T1)=_____。(计算结果)

【答案】bc 减小 小于 小于 5
【解析】
反应A(g)+2B(g) ![]() 2C(g)为气体分子数减小的反应,根据题(3)图可知T2温度下先达到平衡状态,故T1小于T2。
2C(g)为气体分子数减小的反应,根据题(3)图可知T2温度下先达到平衡状态,故T1小于T2。
(1)a.反应开始时A和B按物质的量1:2投料,而A和B也按1:2进行反应,故反应过程中A、B的浓度之比一直为1∶2,不能说明达到平衡,a错误;
b.反应为前后气体分子数减少的反应,故当容器内气体的总物质的量不变时反应达到平衡,b正确;
c.在恒温恒压的条件下,容器体积之比等于气体的物质的量之比,反应前后气体分子数改变,故反应过程中容器体积一直改变,当达到平衡时,气体质量一直不变,容器体积不再改变,则密度不再变化时,反应达到平衡,c正确;
d.根据反应方程式可知,A与C的化学计量数之比为1:2,则生成0.2 mol A的同时生成0.2 mol C,不能说明正逆反应速率相等,不能判定反应达到平衡,d错误;
答案选bc。
(2)达到平衡,通入与反应无关的气体,在恒温恒压条件下,容器体积增大,相当于减小压强,平衡逆向移动,则A的转化率减小。
(3)根据图像可知,T2温度下先达到平衡状态,故T1小于T2,T2温度下C的体积分数减小,说明升高温度平衡逆向移动,则正反应为放热反应,△H小于0;设平衡时C的物质的量为xmol,则A平衡时的物质的量为(1-![]() x)mol,B平衡时的物质的量为(2-x)mol,恒温恒压下,气体体积之比等于气体的物质的量之比,故
x)mol,B平衡时的物质的量为(2-x)mol,恒温恒压下,气体体积之比等于气体的物质的量之比,故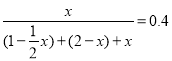 ,解得x=1mol,根据在密闭容器中充入1 mol A和2 mol B后的容积为3L可知,平衡时容器的体积为2.5L,则K(T1)=
,解得x=1mol,根据在密闭容器中充入1 mol A和2 mol B后的容积为3L可知,平衡时容器的体积为2.5L,则K(T1)= ![]() =
= 。
。