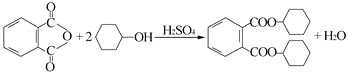
题目内容
【题目】固体NH4I放入一个体积为VL的真空密闭容器中,加热至一定温度后,恒温下发生下列反应:NH4I(s)![]() NH3(g)+HI(g);2HI(g)
NH3(g)+HI(g);2HI(g)![]() H2(g)+I2(g)。平衡时,测得容器中气体共为5mol,其中HI为1.5mol,则下列说法正确的是( )
H2(g)+I2(g)。平衡时,测得容器中气体共为5mol,其中HI为1.5mol,则下列说法正确的是( )
A.平衡时氨气为2.5mol
B.平衡时HI的分解率为20%
C.若开始时放入固体NH4I的量增大一倍,则平衡时气体共为10 mol
D.其他条件不变把容器的体积缩小到V/2 L,重新达到平衡时H2的浓度是原平衡的2倍
【答案】A
【解析】
A、设平衡时氨气是xmol,则分解的HI是x-1.5mol,生成氢气和碘均是(x-1.5mol)/2。所以有x+x-1.5mol+(x-1.5mol)/2+(x-1.5mol)/2=5mol,降低x=2.5mol,正确;
B、分解的HI是(x-1.5mol)/2=0.5mol,所以转化率是![]() ,不正确;
,不正确;
C、NH4I是固体,增大其质量,不会影响平衡,C不正确。
D、增大压强,第一个反应向逆反应方向移动,进而导致HI的浓度降低,使第二个平衡也向逆反应方向移动,所以重新达到平衡时H2的浓度小于原平衡的2倍,不正确;
答案是A。

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目