题目内容
【题目】铅精矿可用于冶炼金属铅,其主要成分为PbS。
I.火法炼铅将铅精矿在空气中焙烧,生成PbO和SO2。
(1)用铅精矿火法炼铅的反应的化学方程式为___________________________。
(2)火法炼铅的废气中含低浓度SO2,可将废气通入过量氨水中进行处理,反应的离子方程式为__________________________________________________。
II.湿法炼铅在制备金属铅的同时,还可制得硫磺,相对于火法炼铅更为环保。湿法炼铅的工艺流程如下:
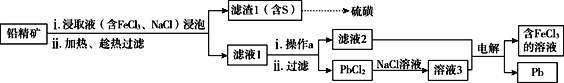
已知:①不同温度下PbCl2的溶解度如下表所示。
温度(℃) | 20 | 40 | 60 | 80 | 100 |
溶解(g) | 1.00 | 1.42 | 1.94 | 2.88 | 3.20 |
②PbCl2为能溶于水的弱电解质,在Cl-浓度较大的溶液中,存在平衡:PbCl2(aq)+2Cl-(aq)![]() PbCl42-(aq)
PbCl42-(aq)
(3)浸取液中FeCl3的作用是___________________________。
(4)操作a为加适量水稀释并冷却,该操作有利于滤液1中PbCl2的析出,分析可能的原因是____________________________________。
(5)将溶液3和滤液2分别置于如图所示电解装置的两个极室中,可制取金属铅并使浸取液中的FeCl3再生。
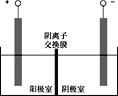
①溶液3应置于_______________(填“阴极室”或“阳极室”)中。
②简述滤液2电解后再生为FeCl3的原理:_____________________。
③若铅精矿的质量为a g,铅浸出率为b ,当电解池中通过c mol电子时,金属铅全部析出,铅精矿中PbS的质量分数的计算式 为_______________。
【答案】 2PbS + 3O2 ![]() 2PbO + 2SO2 2NH3·H2O + SO2
2PbO + 2SO2 2NH3·H2O + SO2 ![]() 2NH4+ + SO32- + H2O 使Pb元素从难溶固体PbS转化成溶液中的PbCl4-,S元素转化成单质硫成为滤渣 加水稀释使PbCl2(aq) + 2Cl-(aq)
2NH4+ + SO32- + H2O 使Pb元素从难溶固体PbS转化成溶液中的PbCl4-,S元素转化成单质硫成为滤渣 加水稀释使PbCl2(aq) + 2Cl-(aq) ![]() PbCl42-(aq)平衡向左移动;温度降低PbCl2溶解度减小 阴极室 阳极发生电极反应:Fe2+ - e-
PbCl42-(aq)平衡向左移动;温度降低PbCl2溶解度减小 阴极室 阳极发生电极反应:Fe2+ - e- ![]() Fe3+(或2Cl- -2e-
Fe3+(或2Cl- -2e- ![]() Cl2;Cl2 + 2Fe2+ = 2Fe3+ + 2Cl-,文字表述也可),使c(Fe3+)升高,同时Cl-通过阴离子交换膜向阳极移动,使FeCl3再生
Cl2;Cl2 + 2Fe2+ = 2Fe3+ + 2Cl-,文字表述也可),使c(Fe3+)升高,同时Cl-通过阴离子交换膜向阳极移动,使FeCl3再生 ![]()
【解析】I.(1)火法炼铅将铅精矿在空气中焙烧,生成PbO和SO2;2PbS + 3O2 ![]() 2PbO + 2SO2;正确答案:2PbS + 3O2
2PbO + 2SO2;正确答案:2PbS + 3O2 ![]() 2PbO + 2SO2。
2PbO + 2SO2。
(2)SO2与过量的氨水反应生成亚硫酸铵,反应的离子方程式为:2NH3·H2O + SO2 ![]() 2NH4+ + SO32- + H2O ;正确答案:2NH3·H2O + SO2
2NH4+ + SO32- + H2O ;正确答案:2NH3·H2O + SO2 ![]() 2NH4+ + SO32- + H2O 。
2NH4+ + SO32- + H2O 。
(3)铁离子具有氧化性,能够把PbS中的Pb氧化为PbCl4-,把S氧化为单质硫;正确答案:使Pb元素从难溶固体PbS转化成溶液中的PbCl4-,S元素转化成单质硫成为滤渣。
(4)加水稀释使PbCl2(aq) + 2Cl-(aq) ![]() PbCl42-(aq)平衡向左移动;温度降低PbCl2溶解度减小,两种操作都有利于PbCl2的析出;正确答案:加水稀释使PbCl2(aq) + 2Cl-(aq)
PbCl42-(aq)平衡向左移动;温度降低PbCl2溶解度减小,两种操作都有利于PbCl2的析出;正确答案:加水稀释使PbCl2(aq) + 2Cl-(aq) ![]() PbCl42-(aq)平衡向左移动;温度降低PbCl2溶解度减小。
PbCl42-(aq)平衡向左移动;温度降低PbCl2溶解度减小。
(5)①根据流程可知溶液3为PbCl42-,滤液2为氯化亚铁溶液,因此溶液3放入阴极室,发生还原反应生成铅;正确答案:阴极室。
②滤液2放入到阳极室,阳极发生电极反应:Fe2+ - e- ![]() Fe3+(或2Cl- -2e-
Fe3+(或2Cl- -2e- ![]() Cl2;Cl2 + 2Fe2+ = 2Fe3+ + 2Cl-),使c(Fe3+)升高,同时Cl-通过阴离子交换膜向阳极移动,使FeCl3再生;正确答案:阳极发生电极反应:Fe2+ - e-
Cl2;Cl2 + 2Fe2+ = 2Fe3+ + 2Cl-),使c(Fe3+)升高,同时Cl-通过阴离子交换膜向阳极移动,使FeCl3再生;正确答案:阳极发生电极反应:Fe2+ - e- ![]() Fe3+(或2Cl- -2e-
Fe3+(或2Cl- -2e- ![]() span> Cl2;Cl2 + 2Fe2+ = 2Fe3+ + 2Cl-,文字表述也可),使c(Fe3+)升高,同时Cl-通过阴离子交换膜向阳极移动,使FeCl3再生。
span> Cl2;Cl2 + 2Fe2+ = 2Fe3+ + 2Cl-,文字表述也可),使c(Fe3+)升高,同时Cl-通过阴离子交换膜向阳极移动,使FeCl3再生。
③根据PbCl42-+2e- ![]() Pb+4Cl- 可知,当电解池中通过c mol电子时,析出金属铅为0.5cmol,根据PbS~Pb关系可知,纯PbS的量为0.5c mol,因此铅精矿中PbS的质量分数的计算式0.5c×239/a×b×100%=
Pb+4Cl- 可知,当电解池中通过c mol电子时,析出金属铅为0.5cmol,根据PbS~Pb关系可知,纯PbS的量为0.5c mol,因此铅精矿中PbS的质量分数的计算式0.5c×239/a×b×100%=![]() ;正确答案:
;正确答案:![]() 。
。