题目内容
【题目】砷(As)是一些工厂和矿山废水中的污染元素。常温下,H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与加NaOH溶液调节pH的关系如图所示(已知:pKa=-lgKa),下列说法错误的是
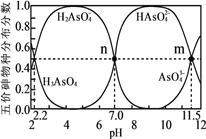
A. Na2HAsO4溶液显碱性
B. H3AsO4溶液pKa2为2.2
C. m点对应溶液中由水电离出的c(OH-)为10-2.5mol·L-1
D. n点对应溶液中离子浓度关系为:c(Na+)>c(HAsO42-)=c(H2AsO4-)>c(H+)=c(OH-)
【答案】B
【解析】分析:A.根据Na2HAsO4溶液pH大于7判断;
B.根据H3AsO4的电离平衡常数计算;
C.m点对应溶液为HAsO42-和AsO43-的混合溶液,溶液显碱性,说明是盐的水解的原因;
D.n点对应溶液pH=7,溶液呈中性,据此解答。
详解:A.根据图象分析可知,HAsO42-溶液pH大于7,溶液显碱性,A正确;
B.H3AsO4的Ka2=![]() ,pH=7时c(HAsO42-)=c(H2AsO4-),Ka2=c(H+)=10-7,pKa2=7,B错误;
,pH=7时c(HAsO42-)=c(H2AsO4-),Ka2=c(H+)=10-7,pKa2=7,B错误;
C.m点对应溶液为HAsO42-和AsO43-的混合溶液,溶液显碱性,盐类水解促进水的电离,m点溶液的pH=11.5,则对应溶液中由水电离出的c(OH-)为10-2.5mol·L-1,C正确;
D.n点对应溶液pH=7,溶液中c(Na+)>c(HAsO42-)=c(H2AsO4-)>c(H+)=c(OH-),D正确;答案选B。

 天天练口算系列答案
天天练口算系列答案【题目】铅精矿可用于冶炼金属铅,其主要成分为PbS。
I.火法炼铅将铅精矿在空气中焙烧,生成PbO和SO2。
(1)用铅精矿火法炼铅的反应的化学方程式为___________________________。
(2)火法炼铅的废气中含低浓度SO2,可将废气通入过量氨水中进行处理,反应的离子方程式为__________________________________________________。
II.湿法炼铅在制备金属铅的同时,还可制得硫磺,相对于火法炼铅更为环保。湿法炼铅的工艺流程如下:
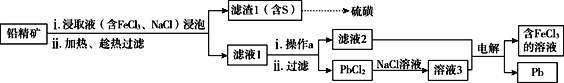
已知:①不同温度下PbCl2的溶解度如下表所示。
温度(℃) | 20 | 40 | 60 | 80 | 100 |
溶解(g) | 1.00 | 1.42 | 1.94 | 2.88 | 3.20 |
②PbCl2为能溶于水的弱电解质,在Cl-浓度较大的溶液中,存在平衡:PbCl2(aq)+2Cl-(aq)![]() PbCl42-(aq)
PbCl42-(aq)
(3)浸取液中FeCl3的作用是___________________________。
(4)操作a为加适量水稀释并冷却,该操作有利于滤液1中PbCl2的析出,分析可能的原因是____________________________________。
(5)将溶液3和滤液2分别置于如图所示电解装置的两个极室中,可制取金属铅并使浸取液中的FeCl3再生。
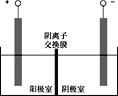
①溶液3应置于_______________(填“阴极室”或“阳极室”)中。
②简述滤液2电解后再生为FeCl3的原理:_____________________。
③若铅精矿的质量为a g,铅浸出率为b ,当电解池中通过c mol电子时,金属铅全部析出,铅精矿中PbS的质量分数的计算式 为_______________。
【题目】锗是一种重要的半导体材料。工业上用精硫锗矿(主要成分为GeS2,杂质不反应)制取Ge,其工艺流程如图所示:

回答下列问题:
(1)开始将精硫锗矿粉碎的目的是______。
(2)高温焙烧精硫锗矿的化学方程式为______。
(3)热还原真空挥发炉内反应的化学方程式为______。
(4)在沉锗过程中,当温度为90℃,pH为14时,加料量(CaCl2/Ge质量比)对沉锗的影响如表所示,选择最佳加料量为______(填“10-15”“15-20”或“20-25”),理由是______。
编号 | 加料量(CaCl2/Ge) | 母液体积 (mL) | 过滤后液含锗(mg/L) | 过滤后液 pH | 锗沉淀率(%) |
1 | 10 | 500 | 76 | 8 | 93.67 |
2 | 15 | 500 | 20 | 8 | 98.15 |
3 | 20 | 500 | 2 | 11 | 99.78 |
4 | 25 | 500 | 1.5 | 12 | 99.85 |
(5)某温度时,沉锗得到的CaGeO3在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是______。

a.n点与p点对应的Ksp相等
b.通过蒸发可以使溶液由q点变到p点
c.q点无CaGeO3沉淀生成
d.加入Na2GeO3可以使溶液由n点变到m点
(6)CaGeO3与强酸反应可得到H2GeO3。0.l molL-1的NaHGeO3溶液pH_____(填“>”“=”或“<”)7,判断理由是______(通过计算比较)。(25℃时,H2GeO3的Ka1=1.7×10-9,Ka2=1.9×10-13。)