题目内容
【题目】碱式碳酸镁可用于牙膏、医药和化妆品等工业,化学式为,Mg(OH)24MgCO35H2O某碱式碳酸镁中含有SiO2杂质,为测定其纯度,某兴趣小组设计了如下几个方案:
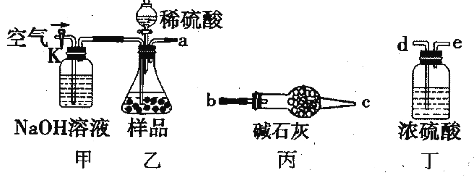
方案Ⅰ
取一定质量的样品,与硫酸充分反应,通过测定生成CO2的质量计算纯度
(1)乙中发生反应的方程式为____________________________。
(2)仪器接口的连接顺序为(装置可以重复使用)a________ ,丁的作用是____________。
(3)关闭止水夹K,向样品中加入足量的稀硫酸,当样品充分反应完后,为了测定准确还应进行的操作是__________________________。
方案Ⅱ
①称取碱式碳酸镁样品m克;②将样品充分高温煅烧,冷却后称量;③重复操作②,测得剩余固体质量为m1克。
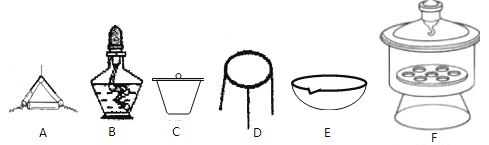
(4)下列仪器中,该方案不会用到的是______________________。
(5)判断样品完全分解的方法是_______________________。
(6)有同学认为方案Ⅱ高温煅烧的过程中会发生MgCO3+SiO2 ![]() MgSiO3+CO2,会导致测定结果有误,你认为这位同学的观点正确吗?________________________(填“正确”或“错误”)请说明自己的理由:_______________________________________________。
MgSiO3+CO2,会导致测定结果有误,你认为这位同学的观点正确吗?________________________(填“正确”或“错误”)请说明自己的理由:_______________________________________________。
(7)求碱式碳酸镁的纯度_______________________(用含有m,m1的式子表示)
【答案】 Mg(OH)24MgCO35H2O+5H2SO4= 5MgSO4+11H2O + 4CO2↑ debcb 除去![]() 中的水蒸气 打开止水夹
中的水蒸气 打开止水夹![]() ,缓慢通入空气 E 样品连续两次高温煅烧,冷却称量质量相差0.1g以内; 错误 该反应的发生不影响生成CO2和水蒸气的量 2.42m1/m×100%
,缓慢通入空气 E 样品连续两次高温煅烧,冷却称量质量相差0.1g以内; 错误 该反应的发生不影响生成CO2和水蒸气的量 2.42m1/m×100%
【解析】(1) Mg(OH)24MgCO35H2O与硫酸反应生成硫酸镁、二氧化碳,反应的方程式为Mg(OH)24MgCO35H2O+5H2SO4= 5MgSO4+11H2O + 4CO2↑;正确答案:Mg(OH)24MgCO35H2O+5H2SO4= 5MgSO4+11H2O + 4CO2↑。
(2)样品与硫酸反应产生的二氧化碳气体中含有水蒸气,先通过丁装置进行干燥,然后进入丙装置进行吸收,为防止外界空气中的二氧化碳、水蒸气进入丙,干扰实验,在重复用丙装置;仪器接口的连接顺序为adebcb;丁中装有浓硫酸,吸收二氧化碳中的水蒸气;正确答案:debcb ;除去CO2中的水蒸气。
(3)关闭止水夹K,向样品中加入足量的稀硫酸,当样品充分反应完后,装置内会残存一些二氧化碳气体,因此,要打开止水夹K,缓慢通入空气,把反应产生的二氧化碳气体全部排出,被丙中的碱石灰吸收,以减小实验误差;正确答案:打开止水夹K,缓慢通入空气。
(4)该实验中要高温煅烧样品,用到A、 B、 C、 D仪器,灼烧后的产物在F中干燥冷却,而蒸发皿用来蒸发液体的,本实验过程中用不到;正确选项 E。
(5)样品连续两次高温煅烧,冷却称量质量相差0.1g以内,样品已完全分解;正确答案:样品连续两次高温煅烧,冷却称量质量相差0.1g以内。
(6)样品高温分解产生二氧化碳和水,高温煅烧的过程中会发生MgCO3+SiO2 ![]() MgSiO3+CO2,也不会影响生成CO2和水蒸气的量,所以方案Ⅱ不会影响测定结果的;正确答案:错误;该反应的发生不影响生成CO2和水蒸气的量。
MgSiO3+CO2,也不会影响生成CO2和水蒸气的量,所以方案Ⅱ不会影响测定结果的;正确答案:错误;该反应的发生不影响生成CO2和水蒸气的量。
(7)样品高温下分解为氧化镁,氧化镁的量为m1/40mol,根据镁元素的量守恒:Mg(OH)24MgCO35H2O~5 MgO关系可知,Mg(OH)24MgCO35H2O的量为m1/200 mol,质量为m1×484/200g,碱式碳酸镁的纯度m1×484/(200×m)×100%=2.42m1/m×100%;正确答案:2.42m1/m×100%。

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案【题目】判断含氧酸酸性强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强。如下表所示:
含氧酸酸性强弱与非羟基氧原子数的关系
次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
含氧酸 | Cl—OH |
|
|
|
非羟基氧原子数 | 0 | 1 | 2 | 3 |
酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
(1)亚磷酸H3PO3和亚砷酸H3AsO3分子式相似,但它们的酸性强弱相差很大,H3PO3是中强酸,H3AsO3既有弱酸性又有弱碱性。由此可知它们的结构式分别为①__________,②__________。
(2)H3PO3和H3AsO3与过量的NaOH溶液反应的化学方程式分别是①__________,②__________。
(3)在H3PO3和H3AsO3中分别加入浓盐酸,分析反应情况__________,写出反应的化学方程式________________________________________________________________________。
【题目】铅精矿可用于冶炼金属铅,其主要成分为PbS。
I.火法炼铅将铅精矿在空气中焙烧,生成PbO和SO2。
(1)用铅精矿火法炼铅的反应的化学方程式为___________________________。
(2)火法炼铅的废气中含低浓度SO2,可将废气通入过量氨水中进行处理,反应的离子方程式为__________________________________________________。
II.湿法炼铅在制备金属铅的同时,还可制得硫磺,相对于火法炼铅更为环保。湿法炼铅的工艺流程如下:
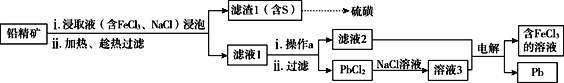
已知:①不同温度下PbCl2的溶解度如下表所示。
温度(℃) | 20 | 40 | 60 | 80 | 100 |
溶解(g) | 1.00 | 1.42 | 1.94 | 2.88 | 3.20 |
②PbCl2为能溶于水的弱电解质,在Cl-浓度较大的溶液中,存在平衡:PbCl2(aq)+2Cl-(aq)![]() PbCl42-(aq)
PbCl42-(aq)
(3)浸取液中FeCl3的作用是___________________________。
(4)操作a为加适量水稀释并冷却,该操作有利于滤液1中PbCl2的析出,分析可能的原因是____________________________________。
(5)将溶液3和滤液2分别置于如图所示电解装置的两个极室中,可制取金属铅并使浸取液中的FeCl3再生。
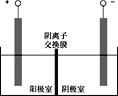
①溶液3应置于_______________(填“阴极室”或“阳极室”)中。
②简述滤液2电解后再生为FeCl3的原理:_____________________。
③若铅精矿的质量为a g,铅浸出率为b ,当电解池中通过c mol电子时,金属铅全部析出,铅精矿中PbS的质量分数的计算式 为_______________。

