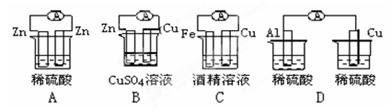
题目内容
将锌片和铜片按图示方式插入柠檬中,电流计指针发生偏转。下列针对该装置的说法正确的是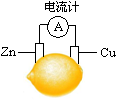
| A.将电能转化为化学能 |
| B.电子由铜片流出 |
| C.锌片是负极. |
| D.铜片逐渐被腐蚀 |
C
解析试题分析:A、该装置是原电池,化学能转化为电能,A不正确;B、原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,锌比铜活泼,锌是负极,铜是正极,因此电子由锌片流出,B不正确;C、锌片是负极,C正确;D、铜是正极,被保护,锌被腐蚀,D不正确,答案选C。
考点:考查原电池原理的应用

锂~碘电池可用来为心脏起搏器提供能源,其电池反应可简化为:2Li + I2 = 2LiI。下列有关说法正确的是
| A.I2发生氧化反应 | B.碘电极为该电池的正极 |
C.正极反应为:Li –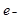 = Li+ = Li+ | D.该电池放电时化学能转化为电能 |
①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池,①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少。据此判断这四种金属活动性由大到小的顺序是
| A.①③②④ | B.①③④② | C.③④②① | D.③①②④ |
银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故。根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去。下列说法正确的是
| A.处理过程中银器一直保持恒重 |
| B.银器为正极,Ag2S被还原生成单质银 |
| C.该过程中总反应为2Al+3Ag2S═6Ag+Al2S3 |
| D.黑色褪去的原因是黑色Ag2S转化为白色AgCl |
一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如下图所示,该电池的电解质为6 mol/LKOH溶液,下列说法中正确的是
| A.放电时K+移向负极 |
| B.放电时电池负极的电极反应为H2-2e-=2H+ |
| C.放电时电池正极的电极反应为NiO(OH)+H2O+e-=Ni(OH)2+OH- |
| D.该电池充电时将碳电极与电源的正极相连 |
下列对如图所示装置实验判断的描述正确的是( )
| | a电极 | b电极 | X溶液 | 实验判断 |
| A | Cu | Zn | H2SO4 | H+向b极迁移 |
| B | Zn | Fe | H2SO4 | a、b极都放出无色气体 |
| C | Al | Mg | NaOH | a为负极,b为正极 |
| D | Cu | 石墨 | FeCl3 | a极质量减小,b极质量增加 |

某MCFC型燃料电池可同时供应电和水蒸汽,其工作温度为600℃~700℃,所用燃料为氢气,电解质为熔融的K2CO3。该电池的总反应为:2H2+O2=2H2O,负极电极反应式为: H2+CO32——2e— H2O+CO2。则下列判断中正确的是 ( )
H2O+CO2。则下列判断中正确的是 ( )
| A.放电时CO32—向负极移动 | B.放电时CO32—向正极移动 |
| C.正极反应: 4OH——4e—=2H2O+O2↑ | D.当电池中生成1 mol水时,转移4 mol电子 |
某充电电池的原理如图所示,溶液中c(H+)="2.0" mol ,阴离子为SO42-,a、b均为惰性电极,充电时右槽溶液颜色由绿色变为紫色。下列对此电池叙述正确的是
,阴离子为SO42-,a、b均为惰性电极,充电时右槽溶液颜色由绿色变为紫色。下列对此电池叙述正确的是
| A.放电过程中,左槽溶液颜色由黄色变为蓝色 |
| B.充电时,b极接直流电源正极,a极接直流电源负极 |
| C.充电过程中,a极的反应式为: VO2++2H++e-= VO2++H2O |
| D.放电时,H+从左槽迁移进右槽 |